Оценивать эффективность CAR-T-терапии острого лимфобластного лейкоза с помощью биолюминесценции от новой разновидности люциферазы предложили ученые из Института молекулярной и клеточной биологии СО РАН и Новосибирского государственного университета. С помощью белка-люциферазы, взятого у морских креветок, исследователи «подсвечивают» раковые клетки, благодаря чему те легко обнаруживаются с помощью специального прибора. Подробнее о технологии корреспонденту «Научной России» рассказал один из авторов исследования, исполняющий обязанности заведующего лабораторией биосенсорных технологий НГУ, кандидат биологических наук Сергей Викторович Кулемзин.
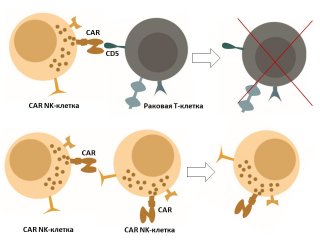
При CAR-T-терапии у человека забирают часть T-лимфоцитов, после чего в них с помощью псевдовирусных частиц встраиваются гены, запускающие в иммунных клетках процесс производства белка-рецептора CAR. Он помогает T-лимфоцитам распознавать патогенные клетки по специфическому сигналу-маркеру на их поверхности.
Исполняющий обязанности заведующего лабораторией биосенсорных технологий НГУ Сергей Викторович Кулемзин.
Фото: Сергей Кулемзин
Лучше всего CAR-T-терапия помогает бороться с онкогематологическими заболеваниями — опухолями В-клеточного происхождения (лейкозами и лимфомами). Но технологии терапии этого заболевания сложно испытывать на лабораторных животных. Объясняется это тем, что рост солидных (плотных) опухолей (во время экспериментов внедряемых мышам подкожно), можно легко измерить штангенциркулем. Но при гемобластозах болезнетворные клетки распространяются по организму, и оценить их количество при жизни животных оказывается затруднительно.
Чтобы решить эту проблему, ученые предложили во время экспериментов внедрять в организмы мышей клетки острого лимфобластного лейкоза человека, заранее модифицированные белком-люциферазой морских креветок NanoLuc. Чтобы «помеченные» раковые клетки начали светиться, животным вводится специальный субстрат.
«Люцифераза, которую мы используем, в целом применяется другими исследователями, но этот фермент сравнительно новый для ученых. Как стандартный маркер в доклинических исследованиях клеточной терапии он почти не используется, — рассказал С.В. Кулемзин. — Мы выбрали именно этот фермент, исходя из целого ряда параметров. В настоящее время во многих исследованиях применяется светлячковая люцифераза, но она намного менее яркая и требует более сложной методики введения субстрата. Поэтому мы решили воспользоваться люциферазой NanoLuc для того, чтобы достичь максимальной яркости и наибольшего удобства при проведении экспериментов».
Сотрудник лаборатории биосенсорных технологий НГУ кандидат биологических наук Сергей Владимирович Гусельников проводит анализ межбелковых взаимодействий.
Фото: Сергей Кулемзин, Татьяна Беловежец / НГУ
Чтобы оценить численность опухолевых клеток с люциферазой, ученые используют прибор IVISSpectrum. Он одновременно делает рентгеновский снимок и фиксирует, сколько фотонов (частиц света) испускает каждый участок организма. Именно второе позволяет с помощью специальной программы составлять карты свечения и таким образом визуализировать расположение опухолевых клеток в теле. На основе измерений составляются таблицы и графики, по которым можно проследить, как меняется количество болезнетворных клеток в разных условиях.
Свечение опухолевых клеток после добавления субстрата хорошо видно даже невооруженным глазом.
Фото: Сергей Кулемзин, Татьяна Беловежец / НГУ
Белок NanoLuc светится почти в десять раз ярче похожих веществ. В результате для аппарата уже заметны даже десять раковых клеток. Сотня клеток испускает отчетливый сигнал, и ее местоположение распознается хорошо. А если число клеток достигнет 10 тыс., их свечение будет столь ярким, что превысит чувствительность прибора, — но это не будет препятствовать экспериментам.
«Особенно высокая яркость этой люциферазы — это, с одной стороны, большой плюс, но, с другой стороны, на некотором оборудовании это может вызывать так называемую засветку, когда мы фиксируем избыточный сигнал и он выходит за границу линейного диапазона детекции, — объяснил С.В. Кулемзин. — Но, к счастью, такое превышение происходит только тогда, когда опухолевая нагрузка слишком высока. А во время экспериментов нам, как правило, необходимо оценивать минимальное присутствие опухолевых клеток, то есть решать задачу под другим углом. Для нас важно не определять разницу между большим и очень большим числом опухолевых клеток, а различать, немного их или они присутствуют в единичном количестве. И данная люцифераза позволяет нам детектировать раковые клетки буквально в штуках».
Примечательно, что другие белки-люциферазы в основном зависят от молекул АТФ, служащих источником энергии для клеток. В опухоли условия неблагоприятны, и АТФ быстро растрачивается, в результате чего свечение таких соединений тускнеет. Однако NanoLuc сохраняет свойства даже в такой среде.
Один из авторов исследования, научный сотрудник лаборатории инженерии антител ИМКБ СО РАН и лаборатории биосенсорных технологий НГУ Татьяна Николаевна Беловежец.
Фото: Сергей Кулемзин / НГУ
Исследователи предлагают создать на основе разработки специальную оценочную шкалу, которая поможет качественно сравнивать действие на клетки рака различных методов терапии. Для этого нужно будет оценить световой сигнал, испускаемый разными линиями модифицированных опухолевых клеток — сначала в виде лабораторных образцов, а затем непосредственно в организмах животных.
«До введения модельным животным мы можем измерить, сколько фотонов за единицу времени испускает каждая конкретная опухолевая клетка, модифицированная люциферазой, — сказал С.В. Кулемзин. — После этого, определив с помощью специального прибора количество фотонов, излучаемое клетками уже в организме мыши, мы можем отнормировать эти данные и в результате понять, сколько опухолевых клеток в данный момент времени реально находятся в модельном животном и где они расположены».
Подробнее об исследовании ученые рассказали в статье в журнале «Гематотология и трансфузиология».
«Часть субстратов для люциферазы производится за рубежом, некоторые сейчас изготавливаются и в России. И закупка реагентов из-за рубежа может быть несколько затруднена, — добавил С.В. Кулемзин. — Я очень рассчитываю, что субстрат, который наиболее удобен для используемой нами люциферазы, тоже начнут производить отечественные химики. Это позволит сделать наши исследования менее дорогостоящими и более доступными».
ИМКБ СО РАН и НГУ входят в междисциплинарную команду новосибирских научных организаций, активно развивающих исследования в области CAR-T-терапии. В работе участвуют НИИ клинической и экспериментальной лимфологии, а также НИИ фундаментальной и клинической иммунологии. Изыскания проводятся при активной высокоуровневой поддержке: по государственному заданию ФНИ FWNR-2025-0014, в рамках программы «Приоритет-2030», и НОЦ «Высокотехнологичная биоэкономика». В планах ученых — разработка новых подходов к улучшению CAR-T-терапии и моделированию развития онкозаболеваний.
Сотрудник лаборатории биосенсорных технологий НГУ Павел Солодков готовится к анализу белков.
Фото: Сергей Кулемзин, Татьяна Беловежец / НГУ
«Текущее исследование было проведено для одной модели онкогематологических заболеваний. Но есть и иные виды рака, и мы хотим воспользоваться этим же подходом для моделирования на животных других онкологических заболеваний», — поделился С.В. Кулемзин.
Автор фото на стоп-кадре видео: Сергей Кулемзин
Новость подготовлена при поддержке Министерства науки и высшего образования РФ
Фото на превью и на странице: Сергей Кулемзин, Татьяна Беловежец / НГУ