Ученые Университета Северной Каролины в Чапел-Хилл под руководством Ци Чжана и Роберта МакГинти использовали технологию криоэлектронной микроскопии для создания первой в истории структуры белка cGAS, связанного с блоком упаковки ДНК внутри ядер клеток человека, - пишет eurekalert.org.
Исследователи впервые определили с высоким разрешением структуру ключевого ДНК-чувствительного белка в системе врожденного иммунитета, называемого cGAS, в то время, когда он связан с нуклеосомой - важнейшей единицей упаковки ДНК внутри ядра клетки.
Это исследование, опубликованное в журнале Science, подробно раскрывает, как нуклеосомы внутри наших клеток блокируют cGAS от непреднамеренного запуска врожденного иммунного ответа организма на нашу собственную ДНК. Работой руководили Ци Чжан - доктор философии, доцент кафедры биохимии и биофизики Медицинской школы Университета Северной Каролины, и Роберт МакГинти - доктор медицинских наук, доцент кафедры химической биологии и медицинской химии фармацевтической школы Университеа Северной Каролины.
«Обнаружение чужеродной ДНК бактериальных и вирусных патогенов и реагирование на них - один из наиболее фундаментальных механизмов защиты хозяина, - сказал Чжан. - Более глубокое понимание функций и регуляции этого важного датчика ДНК окажет глубокое влияние как на фундаментальные исследования, так и на трансляционную разработку терапевтических средств, нацеленных на cGAS, имеющих решающее значение для улучшения здоровья человека».
МакГинти - соавтор исследования - сказал: «Эта работа стала возможной благодаря недавним достижениям в технологии криоэлектронной микроскопии, которая позволяет ученым, как и члены нашей команды, с беспрецедентной ясностью наблюдать за белковыми механизмами внутри наших клеток. Видя, как эти белки функционируют нормально, мы можем понять, как манипулировать их функциями для лечения болезней».
Во врожденной иммунной системе млекопитающих белок циклической GMP-AMP-синтазы (cGAS) обнаруживает чужеродные или поврежденные «собственные» ДНК. После обнаружения ДНК cGAS синтезирует циклический GMP-AMP (cGAMP), - вторую молекулу-мессенджер, которая активирует сигнальный путь cGAS-STING для борьбы с инфекциями, воспалительными заболеваниями и раком.
Поскольку cGAS является «универсальным» датчиком ДНК, его необходимо регулировать, чтобы отличать патогенную ДНК от собственной здоровой ДНК организма, чтобы избежать любых непреднамеренных иммунных реакций. Предыдущие исследования показали, что cGAS обогащен внутри ядра, в котором хранится наша геномная ДНК, но остается загадкой, как cGAS игнорирует нашу собственную здоровую ДНК.
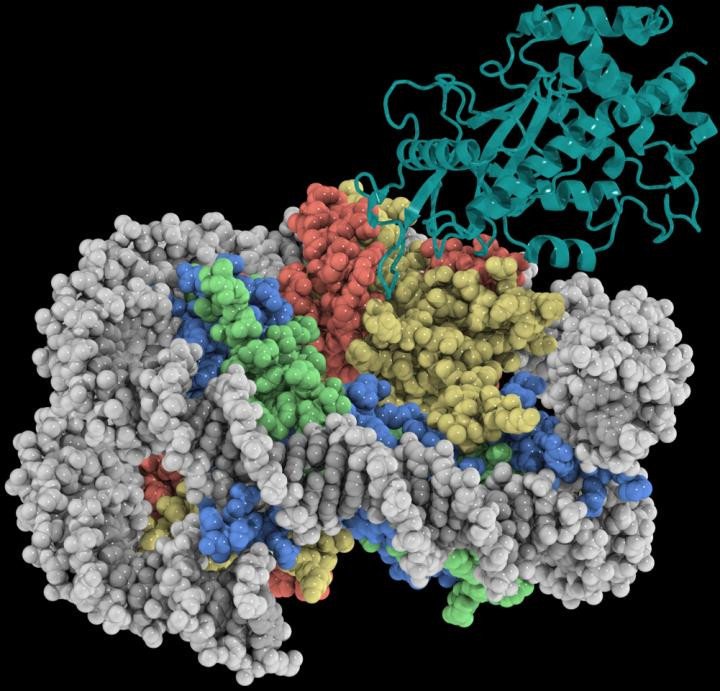
Используя современную лабораторию криоэлектронной микроскопии Медицинской школы UNC, которая была создана в 2019 году, лаборатории Чжана и МакГинти определили криоЭМ-структуру cGAS с разрешением 3,3 Å в комплексе с нуклеосомой. Структура показывает, что cGAS использует две консервативные аминокислоты для прикрепления к отрицательно заряженному участку на поверхности нуклеосомы. Эти белок-белковые взаимодействия позволяют нуклеосоме занимать критически важную сенсорную поверхность ДНК на cGAS и предотвращать переход cGAS в его функционально активное состояние, связанное с ДНК. Вместе с мутагенезом и функциональными анализами это исследование обеспечивает изображение с почти атомарным разрешением того, как cGAS поддерживает покоящееся, подавленное состояние в ядре.
«Эти результаты меняют нынешнюю парадигму регуляции cGAS и иллюстрируют роль нуклеосомы в регуляции различных функций белка», - сказал МакГинти, который одновременно работает на факультете Медицинской школы UNC.
Чжан добавил: «Ученые-биомедики смогут применить наши
исследования в таких областях, как иммунология, биология рака и
регулирование генов, а также для открытия лекарств от инфекций,
воспалительных заболеваний и рака».
[Фото: eurekalert.org]