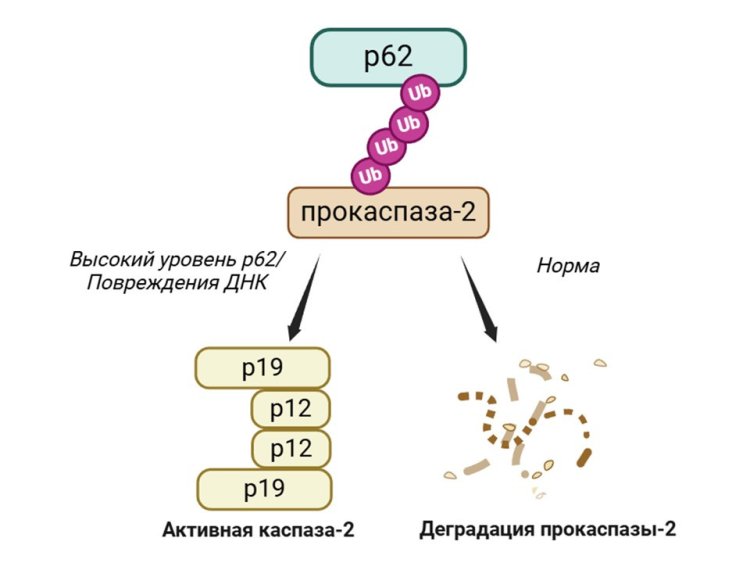
Механизм р62-зависимой регуляции каспазы-2. Источник: Павел Волик
Биологи выяснили, что программируемая клеточная гибель — апоптоз — может запускаться при участии белка р62, который отвечает за разрушение и удаление «лишних» белков из клетки. Поскольку р62 в избытке накапливается при неалкогольном стеатогепатите — заболевании, которое часто приводит к циррозу и раку печени, — описанный механизм может объяснять причины развития этой болезни. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Cell Death & Disease.
В клетках человека и животных существует большое количество регуляторных молекул, одна из которых — каспаза-2. Это фермент, который выполняет сразу несколько функций: регулирует гибель клеток, их жизненный цикл, помогает поддерживать геном в стабильном состоянии и узнавать участки поврежденной ДНК.
Так, например, в клетках с неправильным набором хромосом или поврежденной ДНК каспаза-2 запускает одну из форм гибели — апоптоз, и это препятствует превращению здоровых клеток в раковые. При этом исследования показывают, что обычно каспаза-2 активируется и запускает гибель клеток, когда соединяется с белками-партнерами PIDD1 и RAIDD, образуя сложный белковый комплекс. Однако известны случаи, когда клетка начинает апоптоз и без участия этого комплекса. Поэтому ученые предполагают, что возможен другой путь активации каспазы-2.
Биологи из Института молекулярной биологии имени В.А. Энгельгардта РАН (Москва) с коллегами определили, что каспаза-2 может активироваться и давать сигнал о клеточной гибели, соединяясь с белком р62. Этот белок можно сравнить с уборщиком, поскольку он участвует в разрушении и удалении из клетки выполнивших свою функцию или «лишних» белков.
В работе авторы использовали эмбриональные человеческие клетки, а также клетки рака легкого и нейробластомы (опухоли, поражающей нервную ткань). Из них ученые выделили каспазу-2, а затем молекулярными методами определили, с какими белками она взаимодействует. Связывание наблюдалось между предшественником каспазы-2 (про-каспазой-2) и белком р62. Такое взаимодействие направляло про-каспазу-2 на разрушение и снижало ее уровень, что предотвращало гибель клеток. Если же к клеткам добавляли цисплатин — вещество, вызывающее мутации в ДНК, — запускался другой механизм. В этом случае после повреждения ДНК у про-каспазы-2 появлялась особая молекулярная метка, и связывание с ней р62 приводило к активации фермента и запуску апоптоза.
«Этот механизм, с одной стороны, защищает организм от накопления клеток с мутациями, возникающими после случайного повреждения ДНК, а с другой стороны, позволяет противоопухолевым препаратам "убивать" раковые клетки», — рассказывает участник проекта, поддержанного грантом РНФ, Павел Волик, аспирант кафедры биохимии и регенеративной биомедицины МГУ имени М.В. Ломоносова.
Кроме того, авторы предполагают, что выявленный ими механизм регуляции каспазы-2 с помощью р62 может лежать в основе развития неалкогольного стеатогепатита — заболевания печени, которое может прогрессировать в цирроз и рак печени. Так, недавние исследования показали, что уровни каспазы-2 связаны с накоплением в клетках печени холестерина и вредных жирных кислот. Это, в свою очередь, может ухудшить работу митохондрий — энергетических станций клетки — и привести к гибели клеток. Белок р62 также тесно вовлечен в развитие этих патологий: высокий уровень белка и его включение в тельца Мэллори-Денка (структуры, появляющиеся в клетках печени при нарушении обменных процессов) характерны для пациентов с неалкогольным стеатогепатитом и раком печени и связаны с прогрессированием этих заболеваний.
«Однако молекулярные механизмы, с помощью которых р62 способствует развитию заболеваний печени, остаются неясными, и есть основания предполагать, что описанный нами механизм активации каспазы-2 может лежать в их основе», — рассказывает участник проекта, поддержанного грантом РНФ, Алексей Замараев, кандидат биологических наук, научный сотрудник ИМБ имени В.А. Энгельгардта РАН и лаборатории исследования механизмов апоптоза МГУ имени М.В. Ломоносова.
Таким образом, авторы установили двойную роль белка p62 в регуляции активности каспазы-2. Этот белок может способствовать разрушению каспазы-2 или, напротив, активировать ее. Результаты исследования помогают лучше понять, с помощью каких механизмов клетки контролируют собственную гибель, если в них появляются нарушения, способные привести к различным заболеваниям, в том числе раку.
В исследовании принимали участие сотрудники Московского государственного университета имени М.В. Ломоносова (Москва), Университета имени Отто фон Герике (Германия) и Каролинского института (Швеция).
Информация и фото предоставлены пресс-службой Российского научного фонда