Клетки постоянно отслеживают и перерабатывают свои белки с помощью строго регулируемой системы утилизации отходов. Белки, которые больше не нужны, помечаются и расщепляются с помощью специальных клеточных механизмов. Последние достижения в области разработки лекарств направлены на то, чтобы использовать эту систему, направив ее на борьбу с заболеваниями.
Клеточная стратегия основана на использовании так называемых молекулярных «клеев» — небольших молекул, вызывающих взаимодействие между белками, которые в обычных условиях не связываются друг с другом. Если белок, который вызывает заболевание, вступает в контакт с клеточным ферментом, расщепляющим белки, клетка избирательно удаляет его.
Однако до сих пор большинство молекулярных клеев были открыты случайно, что ограничивало их широкое терапевтическое применение.
Новый метод, разработанный в исследовательском центре молекулярной медицины CeMM в Вене, позволяет преодолеть это ограничение. Исследователи взяли небольшую молекулу, которая связывается с целевым белком, и создали тысячи химических вариантов, систематически присоединяя к ней различные молекулярные блоки. Каждый вариант слегка изменяет форму поверхности белка, создавая новые возможности для межбелковых взаимодействий.
Важно отметить, что эти соединения тестировались непосредственно в живых клетках, без предварительной очистки, с помощью чувствительного анализа, который позволяет определить, разрушается ли целевой белок. Это позволило быстро выявить активные соединения из огромного количества химических веществ.
«Наш подход сочетает высокопроизводительную химию с функциональным тестированием на клетках, — говорит Микель Муньос-и-Ордоньо, первый автор работы. — Это позволяет исследовать химическое разнообразие в масштабах, которые раньше были недостижимы, и при этом сразу видеть, какие соединения обладают желаемым биологическим эффектом».
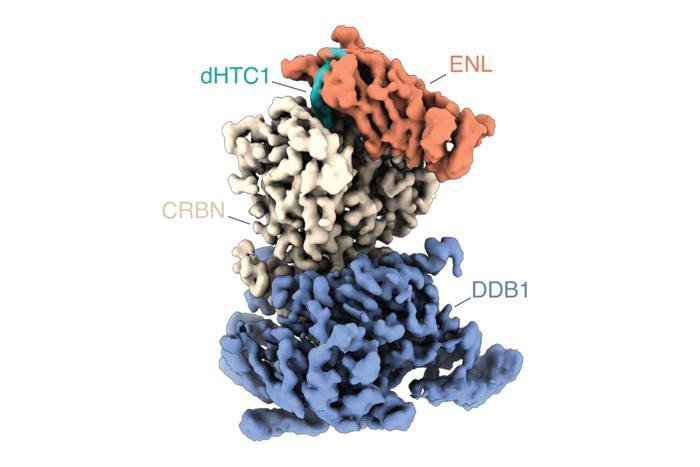
В качестве экспериментального подтверждения исследователи сосредоточились на ENL — белке, который играет ключевую роль при некоторых формах острого лейкоза. Из нескольких тысяч протестированных соединений команда выделила молекулу, которая эффективно и избирательно запускает деградацию ENL в лейкозных клетках.
Дальнейший анализ показал, что соединение в первую очередь влияет на ENL и генные программы, контролируемые этим белком, что приводит к значительному замедлению роста лейкемических клеток, зависимых от ENL. Также выяснилось, что соединение действует по кооперативному механизму, характерному для молекулярных «клеев». Вместо того чтобы прочно связываться со всеми партнерами по взаимодействию, оно сначала связывается с ENL, а затем создает поверхность для взаимодействия, которая привлекает клеточную убиквитинлигазу, которая помечает ENL для последующей деградации.
«Именно этот совместный механизм действия делает молекулярные клеи такими мощными и избирательными, — объясняет Уинтер. — Соединение становится активным только в определенном молекулярном контексте, что помогает избежать нежелательных эффектов».
Помимо конкретного примера с ENL, исследование, опубликованное в Nature Chemical Biology, демонстрирует универсальную стратегию поиска. Сочетая высокопроизводительную химию с функциональным скринингом в клетках, исследователи показывают, как превратить поиск молекулярных «клеев» из случайного в систематический рабочий процесс.
«Наша цель — сделать так, чтобы препараты, вызывающие эффект близости, можно было находить рациональным и масштабируемым способом, — говорит Уинтер. — В долгосрочной перспективе это может открыть совершенно новые терапевтические возможности для белков, которые раньше считались непригодными для создания лекарств».
[Фото: © Miquel Muñoz / CeMM Research Center for Molecular Medicine of the Austrian Academy of Sciences]