Жизнедеятельность человеческого организма в значительной степени зависит от стабильности его генома и правильного воспроизведения хранящейся в нем в виде ДНК информации. В свою очередь, стабильность генома определяется способностью клетки реагировать на повреждения ДНК. Ключевым механизмом регуляции этого процесса является поли-АДФ-рибозилирование белков, участвующих в репарации ДНК. Фундаментальные исследования в этом направлении проводят сотрудники лаборатории биоорганической химии ферментов Института химической биологии и фундаментальной медицины СО РАН под руководством академика Ольги Ивановны Лаврик. Недавно они опубликовали свои результаты в престижном журнале Communications Biology.
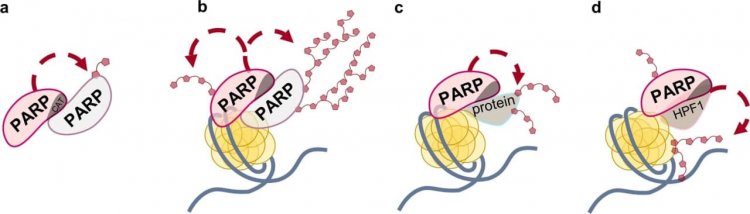
Варианты активности ферментов PARP: а — базальная (ДНК-независимая) активность; b — ДНК-зависимая автомодификация, которая, как предполагается, происходит в цис- и трансвариантах; c — ДНК-зависимая гетеромодификация белка-мишени; d — HPF1-индуцированная гетеромодификация гистонов
Молекула ДНК является библиотекой, в которой содержится информация о функционировании клетки. Хорошо известно, что структуру ДНК охраняют от повреждений системы репарации, состоящие из комплексов белков. Динамические процессы репарации, протекающие в хроматине, требуют участия ферментов-регуляторов. Сегодня наиболее актуальные фундаментальные исследования связаны с АДФ-рибозилированием — внутриклеточной реакцией, которая регулирует многие процессы, в том числе репликацию, транскрипцию и репарацию ДНК. В результате этой реакции, осуществляемой ферментами поли(АДФ-рибоза)-полимеразами, образуется поли(АДФ-рибоза) — специфический полимер, который выполняет важнейшую функцию, а именно привлекает «ремонтные бригады» ферментов репарации к разрывам в молекулах ДНК для их восстановления.
Заведующая лабораторией биоорганической химии ферментов (ЛБХФ) ИХБФМ СО РАН академик Ольга Ивановна Лаврик: «Изучение процессов, происходящих в человеческих клетках, невозможно без понимания механизма АДФ-рибозилирования. В клеточном ядре этот процесс катализируют ферменты поли(АДФ-рибоза)-полимеразы 1 и 2 (PARP1 и PARP2), которые, в сущности, регулируют все важнейшие клеточные системы, поддерживая стабильность и точность воспроизведения генома».
PARP1 — самый главный фермент. Он регулирует ключевые процессы, катализируя при повреждениях ДНК синтез поли(АДФ-рибозы), которую называют третьей нуклеиновой кислотой наряду с ДНК и РНК. Исследование такой фундаментальной реакции необходимо для важнейших медицинских задач, а именно — для поиска мишеней, которые нужно ингибировать, чтобы убить раковую клетку.
PARP1 и PARP2 входят в семейство поли(АДФ-рибоза)-полимераз (PARPs), насчитывающее 18 белков. Функции многих из них еще неясны и являются предметом активных исследований. Первый из открытых белков этого семейства, PARP1, отвечает за обнаружение разрывов ДНК, возникающих при генотоксическом стрессе. Связываясь с разрывами в ДНК, фермент использует НАД+ (кофермент витамина B3, жизненно важный для каждой клетки человеческого организма) для синтеза разветвленного отрицательно заряженного полимера — поли(АДФ-рибозы), той самой «третьей нуклеиновой кислоты». В ходе синтеза поли(АДФ-рибозы) PARP1 сам к себе присоединяет ковалентно этот отрицательно заряженный полимер, чтобы легче покинуть разрывы в ДНК, которая тоже заряжена отрицательно, а также PARP1 может присоединять этот полимер к другим белкам, регулируя их взаимодействие с ДНК. В то же время поли(АДФ-рибоза) может собирать белки в функциональные комплексы, концентрируя их вблизи повреждений ДНК. Синтез поли(АДФ-рибозы) имеет важнейшую сигнальную функцию, а именно — информирует клеточные системы о произошедшем повреждении ДНК точно так же, как столб дыма является сигналом о начавшемся пожаре. Таким образом, PARP1 выступает оператором всех процессов клетки, контролируя целостность генетической информации, заключенной в ДНК.
Еще один представитель семейства PARP, PARP2, принято считать менее активным аналогом PARP1. Он действительно имеет меньшую активность в реакции синтеза поли(АДФ-рибозы), если сравнивать этот фермент с PARP1. Тем не менее было установлено, что неповрежденные клетки, в которых совсем нет PARP1, продолжают полноценно функционировать. Выходит, что PARP2 вполне способен поддерживать жизненные процессы клетки, но как это возможно при гораздо более низком уровне синтеза поли(АДФ-рибозы), оставалось неизвестным.
Учитывая ключевую роль PARP1 и PARP2 в восстановлении повреждений ДНК, понимание механизмов их действия имеет огромное медицинское значение. Ферменты этого семейства белков — отличные терапевтические мишени. Ингибиторы PARP1 подавляют восстановление ДНК в раковых клетках и применяются в качестве противораковых препаратов для лечения рака молочной железы, яичников и ряда других болезней. Было установлено, что PARP1 вовлечен в развитие воспалительных процессов. Например, «гиперактивация» PARP1, сопряженная с расходом НАД+ и понижением энергетического баланса клетки, ответственна за увеличение числа очагов поражения при инсультах, инфарктах миокарда, сепсисе. Это позволяет предположить, что ингибиторы PARP1 могут применяться и для терапии неонкологических заболеваний.
Фермент PARP1 был открыт еще в 60-е годы прошлого века, однако на протяжении десятилетий ученые не подозревали о том, что он взаимодействует с определенным кофактором, белком-помощником, с которым образует единый активный центр. Этот белок был открыт только в 2016 году и назван фактором поли-АДФ-рибозилирования гистонов 1 (HPF1 — histone PARylation factor 1). Именно HPF1 регулирует присоединение синтезируемого полимера АДФ-рибозы к гистонам в составе хроматина.
Аспирантка Новосибирского государственного университета, сотрудник лаборатории биоорганической химии ферментов ИХБФМ СО РАН Татьяна Андреевна Кургина: «Это чрезвычайно важно для процессов репарации, и вот почему: ДНК плотно упакована в клеточном ядре в составе хроматина. Самый первый уровень компактизации — нуклеосомы, ДНК-белковые комплексы, где ДНК намотана на гистоновое ядро, состоящее из белков. В такой структуре некоторые участки ДНК, в том числе содержащие повреждения, экранированы гистонами, а поли-АДФ-рибозилирование гистонов приводит к релаксации данной структуры, делая скрытые участки доступными для репарационных машин».
Исследования сотрудников лаборатории биоорганической химии ферментов ИХБФМ СО РАН показали, что HPF1 способен стимулировать ранние стадии АДФ-рибозилирования и ингибировать поздние. То есть при определенных условиях этот кофермент способен увеличивать количество синтезированного полимера поли(АДФ-рибозы). «На первый взгляд может показаться, что HPF1 взаимодействует с PARP1 и PARP2 крайне неэффективно. Необходимо добавлять очень большой избыток HPF1 по отношению к PARP1 или PARP2, чтобы увидеть образование их комплексов с HPF1. Первые исследования из-за такого кажущегося плохого взаимодействия были проведены при высоких концентрациях HPF1. Результаты исследований показали, что данный фактор мешает PARP1 синтезировать поли(АДФ-рибозу), уменьшает количество и длину синтезируемых полимеров». Однако, как было установлено сотрудниками ЛБХФ, эти данные не совсем верны. Дело в том, что HPF1 гораздо эффективнее образует комплекс с PARP1, когда этот фермент уже активирован. Когда PARP1 связывает поврежденную ДНК и молекулу НАД+, он переходит в режим боевой готовности и его структура изменяется — HPF1 получает возможность связаться с ним, так как открывается площадка для его посадки. В клетке маловероятна ситуация, когда HPF1 будет больше, чем PARP1, как показали соответствующие исследования. Эксперименты, проведенные в условиях, наиболее близких к клеточным, показали, что HPF1, напротив, стимулирует активность PARP1, а также впервые было установлено, что этот белок стимулирует активность PARP2. В результате в присутствии HPF1 «заместитель» PARP1, а именно PARP2, становится по-настоящему активным. Это очень важное наблюдение, проясняющее загадку низкой активности второго PARP в отсутствие HPF1.
Роль НАД+ также чрезвычайно важна, ведь эта молекула поставляет энергию для многих клеточных процессов и выступает кофактором ферментов. Расходовать ее впустую — расточительно и вредно. Если PARP1 сильно активировался и потратил весь НАД+ на синтез, то клетка может погибнуть. В работе сотрудников ЛБХФ было показано, что HPF1 может препятствовать «гиперактивации» PARP1, чтобы он не использовал весь НАД+, который нужен и для других процессов. При низкой концентрации НАД+ HPF1 будет, напротив, стимулировать PARP1 и PARP2 для сохранения сигнала о повреждениях ДНК, инициируя процесс восстановления этих повреждений. Таким образом, HPF1 нормализует активность PARP1 и PARP2, регулируя расход энергии.
Еще один важный результат работы состоит в следующем. Оказалось, что HPF1 оказывает гораздо большее воздействие на PARP2 по сравнению с PARP1. В отличие от PARP1, этот фермент в присутствии HPF1 преимущественно модифицирует гистоны. То есть он участвует не только в создании сигнала о повреждении ДНК, но и создает условия для его репарации на уровне хроматина. Поли-АДФ-рибозилированные гистоны хуже взаимодействуют с ДНК и не мешают процессу репарации. Таким образом, было установлено, что HPF1 особенно необходим в клетке для выполнения функций PARP2, поскольку без этого фактора PARP2 имеет низкий уровень активности. Можно сказать, что многолетняя загадка была разгадана!
«Изучение ферментов семейства PARP, несомненно, имеет огромные перспективы, включая даже такие области, как борьба с COVID-19. Ведь АДФ-рибозилирование — это процесс, участвующий в проникновении коронавируса в хозяйскую клетку. Наша лаборатория является ведущей в России в исследованиях функций белков семейства PARP. В мире этими ферментами активно занимаются ведущие лаборатории. Ежегодно проходят конференции, посвященные только этим ферментам, в силу важности этих исследований для лечения онко- и нейродегенеративных заболеваний. Хочу заметить, что для разработки оптимальных методов лечения совершенно необходимы серьезные фундаментальные исследования. Только фундаментальные исследования могут создать необходимый плацдарм для дальнейшего развития медицины», — прокомментировала Ольга Лаврик.
Глеб Сегеда
Иллюстрация предоставлена исследователями
Источник информации: Управление по пропаганде и популяризации научных достижений СО РАН