Рисунок 1
Сотрудники факультета фундаментальной медицины МГУ имени М.В. Ломоносова обнаружили факторы, отвечающие за устойчивость раковых клеток к препаратам таргетной химиотерапии. В опухолях может повышаться количество определенных белков, предотвращающих гибель клетки и таким образом противостоящих действию препаратов. Ученые выявили эти белки и предложили, как можно подбирать персонализированное лечение, основываясь на их содержании в тканях пациента. Исследование выполнено при поддержке Российского научного фонда (РНФ), его результаты опубликованы в высокорейтинговом научном журнале Cancers.
Химиотерапия, применяемая для лечения рака, вредит и здоровым тканям, что для тяжелых онкологических больных может быть смертельно. Наиболее перспективным направлением является таргетная терапия опухолей, то есть воздействие идет через специфические молекулы и метаболические пути, которые приобретают клетки только в процессе онкогенеза. Одна из мишеней такого подхода — устойчивость опухолей к различным типам программируемой гибели клеток (ПГК), в том числе и апоптозу. ПГК играет важную роль в нормальном развитии и функционировании тканей и органов, избавляет организм от дефектных клеток.
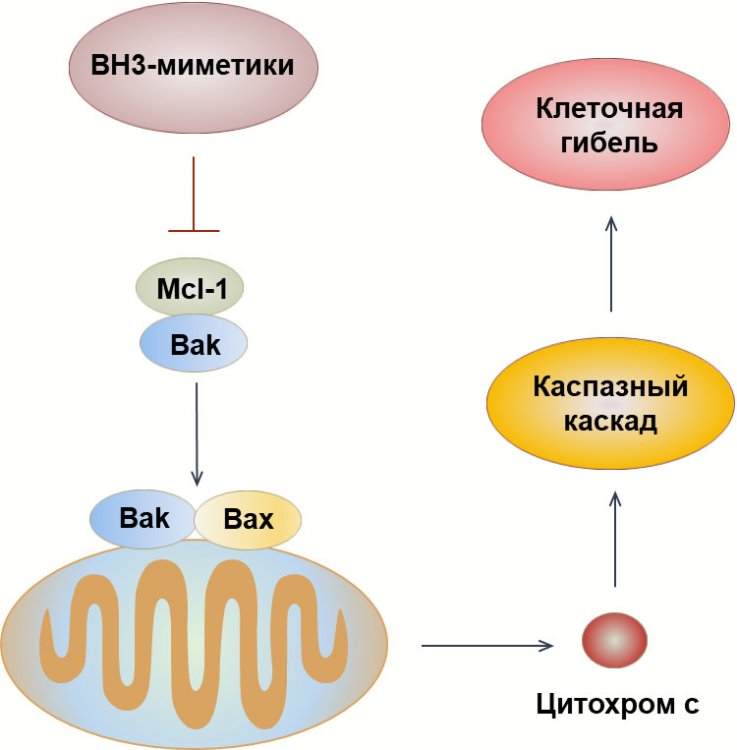
Многие противораковые препараты повреждают опухолевые клетки, запуская апоптоз. Нередко устойчивость новообразований к терапии тесно связана с повышением уровней белков семейства Bcl-2, которые являются блокаторами гибели клеток и обеспечивают их выживание. Среди представителей этого семейства особый интерес представляет белок Mcl-1, поскольку его уровень увеличивается в различных опухолях, что приводит к устойчивости злокачественных клеток к ПГК. Более того, Mcl-1 играет большую роль в невосприимчивости рака к существующим химиотерапевтическим препаратам, что делает его перспективной мишенью таргетной терапии онкологических заболеваний.
«В данном исследовании молодые сотрудники лаборатории Вячеслав Сеничкин, Николай Первушин и Гелина Копеина изучили эффективность действия селективных ингибиторов белка Mcl-1 на различных клеточных моделях солидных ("твердых") опухолей. Исследуемые препараты относятся к классу BH3-миметиков — химических веществ, которые способны высокоаффинно и селективно связываться с различными антиапоптотическими белками семейства Bcl-2. Благодаря своим уникальным свойствам BH3-миметики могут эффективно запускать гибель опухолевых клеток», — рассказывает руководитель лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ, один из авторов исследования, профессор Борис Животовский.
Ученые выяснили, что ключевую роль в запуске гибели при помощи антагонистов Mcl-1 играет белок Bak, который может нарушать целостность мембран митохондрий, выпуская в цитоплазму проапоптотические (то есть вызывающие ПГК) белки. Mcl-1 образует комплексы с Bak, не давая тому выполнить свою функцию, однако BH3-миметики предотвращают это взаимодействие. Также авторы обнаружили важный фактор как исходной, так и приобретенной устойчивости опухолевых клеток к этим препаратам. Им оказалось повышение уровня другого белка семейства Bcl-2 — Bcl-xL. Он входит в состав мембран митохондрий и предотвращает высвобождение из них проапоптотических белков. Если Bcl-xL много, то даже блокировка Mcl-1 противораковыми препаратами не поможет запустить гибель клетки.
«Мы проанализировали содержание изучаемых белков в тканях пациентов с диагностированной аденокарциномой легкого, проходивших лечение в РОНЦ имени Н.Н. Блохина. К счастью, мы обнаружили у них пониженный в сравнении с нормой уровень антиапоптотических белков, а значит, в их случае терапия ингибиторами Mcl-1 будет эффективна. Однако у других больных картина может быть иной, и придется подбирать альтернативные пути лечения. В любом случае анализ содержания в организме представителей семейства Bcl-2 представляет особую важность в контексте развития подходов персонализированной медицины», — подводит итог Гелина Копеина, ответственный исполнитель исследования.
Сотрудники лаборатории продолжают активное изучение вклада белков семейства Bcl-2 в прогрессирование онкологических заболеваний, механизмов исходной и приобретенной устойчивости раковых клеток к фармакологическому ингибированию Mcl-1, а также способов преодоления этой устойчивости. Полученные в процессе работы знания помогут усовершенствовать подходы, направленные на нейтрализацию Mcl-1 в рамках противоопухолевой терапии. Актуальность проведенного исследования подтверждается большим научным интересом к классу BH3-миметиков. Так, антагонист белка Bcl-2 («Венетоклакс») был разрешен к применению на территории РФ, а ряд ингибиторов Mcl-1 сейчас находится на разных стадиях клинических испытаний.
Рисунок 1. Антиапоптотический белок Mcl-1 образует комплексы с проапоптотическими белками семейства Bcl-2 и тем самым не позволяет проапоптотическим белкам Bax и Bak образовывать поры во внешней мембране митохондрий. Такой механизм взаимодействия блокирует выход цитохрома с из митохондрий и активацию каспазного каскада, ведущего к необратимой гибели раковых клеток. Для нейтрализации антиапоптотической активности Mcl-1 были разработаны специальные химические соединения — BH3-миметики, способные связываться с Mcl-1 и эффективно запускать гибель клеток опухолей. Источник: Борис Животовский.
Информация и иллюстрация предоставлены пресс-службой Российского научного фонда