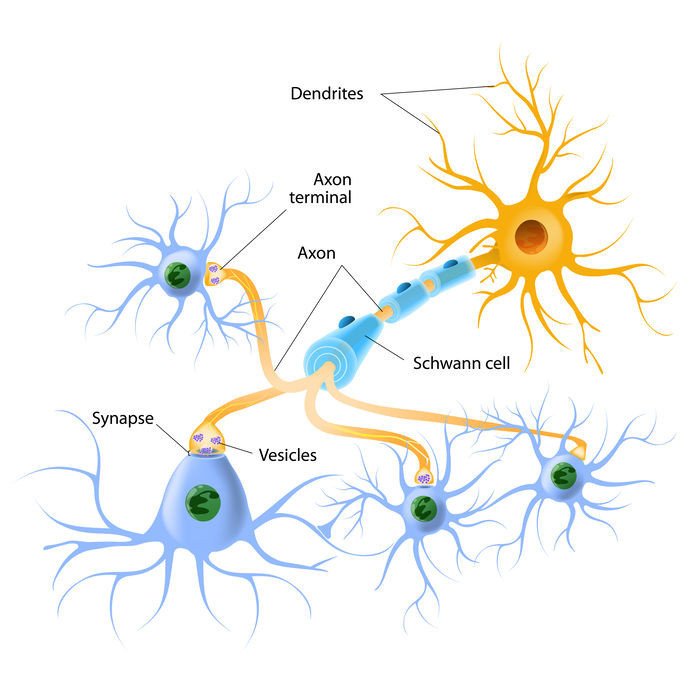
Исследователи обнаружили неожиданную роль белков теплового шока во время развития нейронов, - пишет eurekalert.org со ссылкой на Development.
Исследование проводила группа во главе с доктором Чаогу Чжэн из Школы биологических наук при Гонконгском университете в сотрудничестве с командой профессора Мартина Чалфи (Нобелевский лауреат по химии 2008 года) из Департамента биологических наук Колумбийского университета. Им удалось обнаружить неожиданную роль белков теплового шока (HSP), также известных как молекулярные шапероны, во время дифференцировки нейронов – когда нейрон приобретает свою форму и функцию. Известно, что HSP защищают клетки от различных стрессов: например, экстремальных температур, токсинов и механических повреждений, а также для защищают развитие тканей. Это новое исследование, однако, предполагает, что HSP также может играть ингибирующую роль в дифференцировке нейронов путем дестабилизации цитоскелета нейронов.
Контроль качества белка важен для нормального развития клеток человека, а нарушение его регуляции приводит к ряду нарушений развития нервной системы. Внутри клеток HSP и другие шапероны способствуют сворачиванию и стабильности белка, в то время как система убиквитинирования и протеасомы (UPS) направляет белки к деградации. Пути HSP и UPS часто сотрудничают, чтобы устранить неисправные белки в некоторых клеточных пластах, но их взаимодействие в развивающихся нейронах недостаточно изучено. Используя нейроны из модельного организма под названием Caenorhabditis elegans, которым можно легко генетически манипулировать, исследовательская группа обнаружила, что, когда система UPS подвергается риску генетических мутаций, большая часть цитоскелета, называемая микротрубочками, дестабилизируется, что приводит к дефектам роста аксонов (отросткам нейронов). Удивительно, но с помощью генетического скрининга команда обнаружила, что удаление HSP и сопутствующих шаперонов может полностью избавить от дефектов, вызванных UPS, что позволяет предположить, что две системы противостоят друг другу во время развития.
Кроме того, было обнаружено, что протеинкиназа, называемая DLK-1, стабилизируется с помощью HSP и разлагается с помощью UPS. Переизбыток DLK-1 вызвал нестабильные микротрубочки и дефекты роста нейронов. Таким образом, регулируя те же белки-мишени, HSP и UPS могут точно настраивать уровень критических сигнальных молекул и создавать строго контролируемый баланс между стабильностью и деградацией белка. Открытие этих механизмов может помочь понять молекулярные основы заболеваний нервной системы, регенерации нервов и развития нейродегенеративных заболеваний.
«Это исследование идентифицирует ранее недооцененную роль HSP в
развитии нейронов и предполагает, что HSP не всегда могут
защищать клеточную морфологию и функции», - сказал д-р Чжэн. В то
же время это исследование также открывает новое направление для
понимания антагонизма между HSP и системой UPS в поддержании
баланса между стабилизацией белка и его деградацией. В
дальнейшем, д-р Чжэн предполагает, что исследование будет
сфокусировано на выявлении общих целей HSP и UPS, которые будут
критической контрольной точкой не только развития нейронов, но и
регенерации нейронов. Д-р Чжэн предполагает, что полное понимание
этой взаимосвязи может помочь определить ключевые терапевтические
цели в лечении многих неврологических заболеваний.
[Фото: ru.123rf.com/profile_designua]