Биолог Дмитрий Дмитриевич Жданов рассказал корреспонденту «Научной России» об альтернативном сплайсинге РНК ― фундаментальном процессе, который происходит при реализации генетической информации и обеспечивает разнообразие белков в организме всех живых существ. Как альтернативный сплайсинг связан с развитием различных заболеваний и старением и можно ли им управлять? Как и когда он мог появиться? В чем его главное эволюционное значение? Подробнее об этом ― в нашем интервью.
Справка: Дмитрий Дмитриевич Жданов ― доктор биологических наук, заведующий лабораторией медицинской биотехнологии НИИ биомедицинской химии им. В.Н. Ореховича (ИБМХ), руководитель проекта РНФ «Модуляция супрессорной активности регуляторных Т-клеток человека путем индукции альтернативного сплайсинга пре-мРНК FoxP3» (2023–2024), профессор кафедры биохимии им. ак. Т.Т. Березова Российского университета дружбы народов им. Патриса Лумумбы, лауреат премии Правительства Москвы молодым ученым за 2022 г. Докторская диссертация Д.Д. Жданова «Роль эндонуклеазы EndoG в регуляции альтернативного сплайсинга пре-мРНК апоптотических белков» признана ВАК одной из лучших в 2020 г.
― Что представляет собой сплайсинг РНК?
― Термин «сплайсинг» исторически связан с мореплаванием и обозначает особый способ соединения канатов ― без образования узлов. Splice переводится с английского языка как «соединять». Если говорить о биологии, то процесс сплайсинга связан с созреванием промежуточного звена РНК. Известно, что информация о последовательности аминокислот в белке закодирована в структуре ДНК. Экспрессия генов, то есть считывание РНК с матрицы ДНК, называется транскрипцией. После ее реализации наступает этап созревания РНК, а после этого с матрицы РНК (в ходе трансляции) происходит непосредственно синтез молекулы белка.
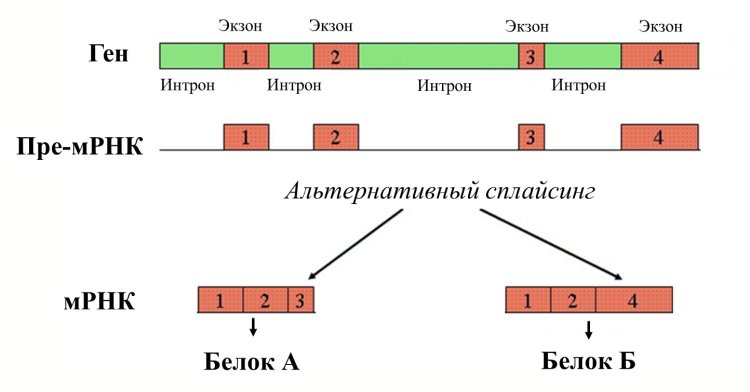
В генах, кодирующих белки, присутствуют экзоны ― участки, кодирующие аминокислотную последовательность, а между ними ― участки, которые не кодируют аминокислоты, но присутствуют в структуре гена. Это интроны.
Когда с ДНК считывается молекула РНК, туда включаются как экзоны, так и интроны. Это называется молекулой пре-мРНК, то есть предварительной матричной РНК. Далее некодирующие участки, интроны, из пре-мРНК вырезаются, а кодирующие ― соединяются друг с другом, то есть происходит их сплайсинг ― соединение.
― В одной из лекций я слышала такую аналогию: это что-то вроде видеозаписи, из которой вырезали рекламу и оставили только смысловую часть.
― Да, так и есть.
― А что происходит с вырезанными кусками?
― Они подвергаются процессу деградации. Такие участки распознаются клеточной системой контроля РНК как «бракованные» нуклеиновые кислоты: она разрушает их до отдельных нуклеотидов.
― Интроны можно назвать бесполезной частью ДНК?
― Нет. В них находятся регуляторные последовательности, необходимые для реализации экспрессии генов и протекания того же самого альтернативного сплайсинга.
У человека суммарное содержание белок-кодирующих участков всех хромосом не превышает 2% от суммарной длины хромосом. Таким образом, 98% нашего генома составляет некодирующая часть. Фото: phonlamaiphoto / 123RF
― Чем альтернативный сплайсинг отличается от просто сплайсинга, о котором мы говорили выше?
― Альтернативный сплайсинг ― это процесс избирательного удаления, перестановки или включения экзонов в зрелую мРНК, то есть он происходит на этапе, когда все интроны уже вырезаны. Известны несколько видов альтернативного сплайсинга, и самый распространенный из них ― удаление или включение экзонов ― можно встретить у всех млекопитающих, в том числе у человека.
― А у бактерий, например, альтернативный сплайсинг тоже происходит?
― Да, он реализуется у всех существующих в природе организмов.
― Правда ли, что интроны изначально могли быть паразитами и потому вырезались из организма, но затем, видимо, как-то прижились?
― С эволюционной точки зрения все, что происходило на заре альтернативного сплайсинга, достаточно интересно. Действительно, изначально интроны могли быть некими «мусорными» участками, привнесенными вирусами в геном первых организмов. Они также могли появиться там и в результате каких-то спонтанных генетических мутаций, перестроек хромосом, когда участок от одной хромосомы переносится к другой. Альтернативный сплайсинг можно рассматривать как процесс адаптации клетки к изменяющимся условиям среды.
Древним клеткам, обитавшим на Земле миллиарды лет назад, необходимо было удалить из себя какие-то вредные участки, мешающие им выживать. Впоследствии эти участки стали функциональными и сохранились у нас в виде процесса альтернативного сплайсинга, приводящего к разнообразию белков, синтезируемых с одного гена.
― В чем принципиальное эволюционное значение альтернативного сплайсинга?
― В первую очередь в том, что он определяет разнообразие белков. Благодаря альтернативному сплайсингу один ген может давать начало сразу нескольким белкам, хоть и гомологичным, похожим друг на друга. Но они тем не менее будут иметь некоторые, пусть и небольшие отличия, что может приводить к тому, что такие белки будут функционировать уже по-другому. То, что один ген может давать начало сразу нескольким белкам, определяет в том числе и определенную компактизацию генома: альтернативный сплайсинг дает возможность хранить информацию более экономно. Кроме того, он обеспечивает некую эволюционную гибкость.
Альтернативный сплайсинг и разнообразие белков ― это всегда процесс адаптации клетки и целого организма к изменяющимся условиям.
Можно задаться вопросом: а зачем нам нужно столько изоформ, то есть похожих белков? Но если что-то случится, то, возможно, эти изоформы как раз таки и сберегут клетку от гибели или, наоборот, уничтожат ее тогда, когда это будет необходимо организму.
Упрощенное схематичное изображение альтернативного сплайсинга. Иллюстрация: California State University San Marcos
― Как и когда был открыт альтернативный сплайсинг?
― В 1970-х гг. американские биологи Филлип Шарп и Ричард Робертс изучали в Массачусетском технологическом институте аденовирусы. Они обнаружили, что двумя независимыми способами на одном гене вируса могут синтезироваться пять транскриптов, то есть копий мРНК (впоследствии ― белков), отличающихся друг от друга. В 1993 г. за это открытие ученые были удостоены Нобелевской премии с формулировкой «за открытие разделенных генов».
― По сути, за открытие прерывистой, дискретной структуры гена?
― Да. Впоследствии такие кодирующие и некодирующие участки, экзоны и интроны, были обнаружены не только у вирусов, но и у бактерий, грибов и всех других живых организмов.
― Насколько древний этот механизм альтернативного сплайсинга?
― Сказать точно сложно. Думаю, его появление по времени совпало с тем периодом, когда появился сам процесс реализации генетической информации в виде «ДНК ― РНК ― белок», а это около 4 млрд лет назад.
― То есть не в РНК-мире, а позже, когда уже появилась ДНК?
― Есть разные точки зрения на этот счет. На самом деле это могло произойти и ранее, еще в РНК-мире. В прошлом РНК могла функционировать самостоятельно, а значит, и первые примитивные организмы могли уже тогда обладать механизмом альтернативного сплайсинга. Такого взгляда, например, придерживается упомянутый Филлип Шарп.
― В одной из своих лекций он говорил также о том, что около четверти всех мутаций, которые могли бы вызвать заболевания, вырезаются как раз в процессе альтернативного сплайсинга.
― На самом деле альтернативный сплайсинг не только защищает от ряда заболеваний, но может и, наоборот, провоцировать их.
На текущий момент идентифицировано около сотни заболеваний, которые так или иначе связаны с ошибками функционирования альтернативного сплайсинга.
Один из примеров, который у всех на слуху, ― это карликовость, заболевание, проявляющееся в задержке роста. Один из гормонов, ответственных за развитие нашего организма (соматотропин), в норме имеет размер 20 кДа. Но в случае с карликовостью из-за неправильного альтернативного сплайсинга удаляется третий экзон в кодирующей его мРНК и в организме синтезируется дефективный белок-соматотропин меньшего размера (17 кДа), что не позволяет ему выполнять свою функцию.
Большинство заболеваний, ассоциированных с альтернативным сплайсингом, генетически обусловлены, то есть имеют врожденную природу. Их причиной выступает нуклеотидная мутация в структуре ДНК, «диктующая» той «машине», что осуществляет альтернативный сплайсинг, удалить тот или иной экзон.
― В целом мутации в организме в основном локализуются в экзонах, то есть в кодирующей части генома, или в интронах?
― По-разному. Все зависит от того, где находится эта мутация и какой функциональный участок затрагивает. Критические мутации могут располагаться как внутри экзона, так и внутри интрона. Именно поэтому мы апеллируем к тому, что интроны не всегда представляют собой «мусорные» части генома. Как я уже говорил, они важны именно для регуляции генов и реализации генетической информации.
― Можно ли терапевтически воздействовать на ошибки альтернативного сплайсинга, приводящие к различным заболеваниям?
― Да, и сегодня в мире уже есть два успешных примера: в США были созданы лекарства, корректирующие процесс альтернативного сплайсинга. Первым заболеванием, для которого был одобрен подобный препарат, стала спинальная мышечная атрофия, а вторым ― мышечная дистрофия Дюшенна, также связанная с поражением скелетной мускулатуры. Так что научные работы в этом направлении активно ведутся.
Нарушение сплайсинга генов ассоциировано с рядом заболеваний: семейной дизавтономией, расстройствами аутистического спектра, болезнью Альцгеймера и др. Фото: deniskot / 123RF
― Как альтернативный сплайсинг связан со старением?
― Старение ― это комплексный процесс, нарушающий все функциональные системы нашего организма, а поскольку внутри нас работают в первую очередь белки, старение также будет приводить к процессам, меняющим их функционирование, в том числе к нарушению альтернативного сплайсинга. Это подтверждается недавним исследованием наших китайских коллег, которые проанализировали РНК-последовательности более чем у 1 тыс. пациентов и обнаружили изменения в сплайс-вариантах свыше 6 тыс. белков.
― Получается, что с возрастом механизм альтернативного сплайсинга нарушается?
― Я бы не сказал, что нарушается сам механизм альтернативного сплайсинга: изменяется тот набор мРНК, которые производятся в результате альтернативного сплайсинга. А в какую сторону пойдут эти изменения, нужно уже смотреть индивидуально.
― Вы занимаетесь исследованием роли альтернативного сплайсинга в развитии аутоиммунных заболеваний в лаборатории медицинской биотехнологии НИИ биомедицинской химии им. В.Н. Ореховича. Что стало для вас самым интересным и самым сложным в этой работе?
― Я напомню, что при таких заболеваниях иммунная система организма начинает атаковать собственные здоровые клетки и ткани. Мы работаем с тремя аутоиммунными заболеваниями: рассеянным склерозом, боковым амиотрофическим склерозом и синдромом Шегрена. Мы проводим эксперименты с регуляторными Т-клетками, функция которых нарушена у пациентов с данными диагнозами.
Мы выяснили, что альтернативный сплайсинг одного из белков, участвующих в созревании, пролиферации и функционировании этих клеток, у пациентов с аутоиммунными заболеваниями нарушен и не способен индуцировать экспрессию своих целевых генов.
Этот белок называется FOXP3. По аналогии с упомянутым выше препаратом для лечения спинальной мышечной атрофии мы подобрали олигонуклеотиды (короткие фрагменты ДНК или РНК, состоящие из нескольких нуклеотидов. ― Примеч. ред.), способные таргетно взаимодействовать с пре-мРНК FOXP3 и переключать его альтернативный сплайсинг в сторону синтеза функционально активного белка.
Дмитрий Дмитриевич Жданов ― лауреат премии Правительства Москвы молодым ученым (2022) за работу «Модуляция клеточных процессов переключающими сплайсинг олигонуклеотидами и роль эндонуклеазы EndoG в регуляции альтернативного сплайсинга». Фото: Ольга Мерзлякова / «Научная Россия»
Самым сложным этапом для нас оказался подбор последовательности этих терапевтических олигонуклеотидов, изменяющих течение альтернативного сплайсинга. Сначала с помощью специальных ИИ-программ нужно было идентифицировать регуляторный участок альтернативного сплайсинга, на который мы должны воздействовать. Затем, уже с помощью естественного интеллекта, мы стали анализировать, подходит ли этот участок к нашим критериям. Далее начался подбор олигонуклеотидов, способных модулировать альтернативный сплайсинг. Сложность подобной работы заключается в том, что если олигонуклеотид будет слишком коротким (мы рассматривали от 20 азотистых оснований), то, возможно, он будет специфичен к множеству других мест в нашем геноме и начнет вызывать нежелательные побочные эффекты. Если же он будет слишком длинным, то его может быть намного труднее доставить в клетку. Процесс доставки таких геннотерапевтических препаратов к клетке ― одна из важнейших задач современной науки. Выполняя такую работу, мы должны пройти по тонкому лезвию бритвы между специфичностью и эффективностью трансфекции (введения нуклеиновой кислоты в эукариотические клетки невирусным методом. ― Примеч. ред.). Это и стало для нас самым главным вызовом.
Интервью проведено при поддержке Министерства науки и высшего образования РФ