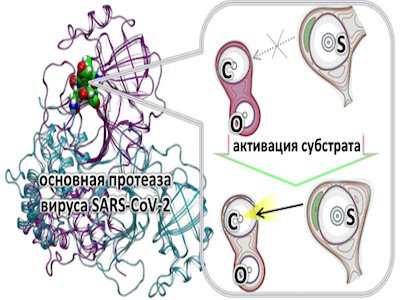
Ученые из ФИЦ Биотехнологии РАН совместно с командой российских ученых предложили новый подход для количественного описания активации соединения в активном центре фермента. Этот подход успешно применен для определения молекулярного механизма необычной субстратной специфичности основной протеазы вируса SARS-CoV-2 и может быть использован для поиска перспективных терапевтических средств борьбы с коронавирусом, образующих ковалентные комплексы с данным ферментом.
Ученые из ФИЦ Биотехнологии РАН совместно с командой российских ученых разработали уникальный подход, позволяющий изучать субстратную специфичность ферментов, используя суперкомпьютерные методы молекулярного моделирования, не проводя сложных и дорогостоящих экспериментов.
Ферменты – белковые макромолекулы, эффективно проводящие определенную химическую реакцию (природные катализаторы) – обладают так называемой субстратной специфичностью, то есть способностью эффективно проводить реакцию со строго определенным исходным веществом (субстратом). Процесс химических превращений субстрата происходит в области фермента, называемой активным центром, и ранее существовало лишь качественное представление о роли фермента в активации соединения в активном центре. Предложенный подход позволяет визуализировать процесс активации и количественно охарактеризовать его.
Проведенное исследование подробно описано в авторитетном научном журнале Английского королевского химического общества Physical Chemistry Chemical Physics, была замечена научным сообществом и включена редакцией журнала в тематическую коллекцию «2020 PCCP HOT Articles».
Реализация такой методики стала возможной благодаря совместным усилиям ученых, специализирующихся в молекулярном моделировании ферментативных реакций из МГУ, ИБХФ РАН и ФИЦ Биотехнологии РАН и специалиста в области квантовой химии из РХТУ. При проведении исследования был разработан уникальный подход, основанный на совместном применении метода молекулярной динамики с потенциалами комбинированного метода квантовой механики / молекулярной механики и последующего анализа электронной плотности в различных кадрах молекулярно-динамической траектории.
Новый способ визуализации и количественной оценки активации субстрата ферментом был использован для решения крайне актуальной на сегодняшний день фундаментальной задачи, связанной с определением молекулярного механизма субстратной специфичности одного из важнейших белков коронавируса – основной протеазы. Этот фермент «разрезает» синтезированный полипептид на фрагменты в строго определенных местах. Полученные фрагменты уже формируют набор белков, необходимых для функционирования вируса.
Ингибирование, то есть блокирование проведения химической реакции, основной протеазы коронавируса останавливает выработку необходимых для функционирования вируса белков и вирус погибает. Наиболее перспективным подходом является разработка так называемых ковалентных ингибиторов. Этот подход основан на образовании ковалентной (химической) связи между ингибитором и ферментом и полностью блокирует работу последнего. Однако для того чтобы такая химическая реакция проходила эффективно, необходима активация ингибитора ферментом, то есть нужно подготовить ингибитор для быстрой химической реакции. Новая разработанная методика дает возможность понять молекулярный механизм необычной субстратной специфичности основной протеазы вируса SARS-CoV-2 и позволяет количественно оценить эффективность активации, а также отобрать перспективные ковалентные ингибиторы для экспериментальной проверки.
Новый подход для количественного описания активации соединения в активном центре фермента позволил решить важную фундаментальную задачу визуализации процесса активации субстрата с точки зрения свойств электронной плотности, а также имеет важное прикладное значение, в частности, для поиска перспективных терапевтических средств борьбы с коронавирусной инфекцией.
Пресс-служба ФИЦ Биотехнологии РАН