Врождённый амавроз Лебера (ВАЛ) — это наследственное заболевание сетчатки, которое приводит к серьёзному ухудшению зрения с младенчества и встречается у 2–3 из 100 000 новорождённых. ВАЛ вызывается мутациями в определённых генах, которые отвечают за выработку белков, необходимых для функционирования и выживания клеток сетчатки.
Мутации в более чем 20 различных генах могут вызывать ВАЛ, и в каждом из этих генов происходят сотни различных изменений, известных как генетические варианты. Важно отметить, что некоторые из этих генетических вариантов являются доброкачественными и не влияют на функции организма, в то время как другие вызывают дисфункцию или полную потерю зрения. Кроме того, в отношении некоторых вариантов, которые называются вариантами неопределённой значимости (VUS), в настоящее время неизвестно, являются ли они причиной заболевания или они доброкачественные.
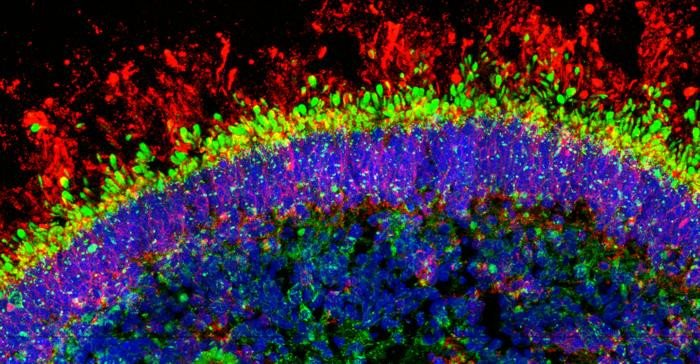
Исследовательская группа Робин Джеймисон из Института детских медицинских исследований Сиднейского университета создала лабораторную платформу тестирования для классификации VUS в органоидах сетчатки, которые представляют собой небольшие трехмерные структуры клеток, напоминающие сетчатку глаза человека. Эта работа была опубликована в журнале Stem Cell Reports.
Органоиды сетчатки были выращены из незрелых стволовых клеток, взятых у пациента с ВАЛ с известными патогенными вариантами гена RPGRIP1, и у второго пациента, который носил VUS в том же гене. Органоиды обоих пациентов имели явные аномалии, такие как меньшее количество светочувствительных фоторецепторов и изменённая экспрессия генов.
Выявив «биомаркеры» RPGRIP1-ассоциированной ВАЛ в органоидах сетчатки, команда Джеймисона пошла дальше и вставила VUS RPGRIP1 в здоровые органоиды сетчатки. Удивительно, но в генетически модифицированных органоидах сетчатки также произошли изменения, подтверждающие, что VUS в гене RPGRIP1 действительно является патогенным. Кроме того, при повторном введении здорового гена RPGRIP1 в органоиды сетчатки вызванные заболеванием изменения были обращены вспять.
Новую платформу можно использовать для классификации новых случаев VUS в RPGRIP1. В конечном счёте полученные знания помогут в разработке таргетной терапии для пациентов с ВАЛ, а также в принятии решений и генетическом консультировании групп риска.