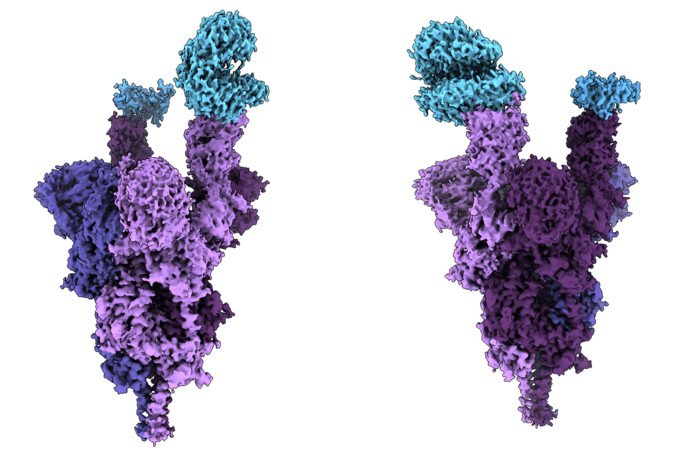
Исследователи с медицинского факультета Университета Британской Колумбии (Канада) провели первый в мире структурный анализ на молекулярном уровне шиповидного белка коронавирусного штамма омикрон. Анализ показал, насколько цепко мутировавший вариант вируса прикрепляется к клеткам человека и заражает их, сообщает пресс-служба вуза. Статья с результатами исследования недавно была опубликована в журнале Science.
«Понимание молекулярной структуры вирусного шиповидного белка важно, так как это позволит нам разработать более эффективные методы лечения от омикрона и его родственных вариантов в будущем, – отмечает ведущий автор исследования доктор Шрирам Субраманиам, профессор Университета Британской Колумбии. – Анализируя механизмы, с помощью которых вирус заражает клетки человека, мы можем разработать более эффективные методы лечения, которые нарушат этот процесс и нейтрализуют вирус».
Спайковый белок на поверхности короновируса позволяет SARS-CoV-2 проникать в клетки человека, цепляясь за клеточный рецептор ACE2. У штамма омикрон беспрецедентное количество мутаций в шиповидном белке – 37, что в три-пять раз больше, чем в предыдущих вариантах.
Структурный анализ показал, что несколько мутаций (R493, S496 и R498) создают новые связи между шиповидным белком вируса и рецептором клетки человека. Эти новые связи, по-видимому, увеличивают аффинность связывания – показатель того, насколько сильно вирус прикрепляется к клеткам, – в то время как другие мутации (K417N) уменьшают силу этой связи.
Также выяснилось, что омикрон лучше уклоняется от антител – как вакцинированных, так и невакцинированных пациентов. Однако, отмечают авторы работы, этот штамм с меньшим успехом остается незамеченным для иммунитета, созданного вакцинами, по сравнению с «естественным» иммунитетом, который сформировался у непривитых пациентов, перенесших ковид.
На иллюстрации фиолетовым цветом обозначен спайковый белок омикрона, голубым – рецептор ACE2.
[Иллюстрация: UBC FACULTY OF MEDICINE]