Учёные-биологи из СФУ и Института биофизики СО РАН представили анализ данных о физико-химических свойствах и применении люцифераз веслоногих рачков в качестве биолюминесцентных репортеров.
Яркое голубое свечение некоторых крохотных морских веслоногих рачков (копепод), составляющих планктон, это выделение из эпидермальных желез в ответ на разные стимулы (например, при нападении хищников), но состав светящегося секрета до сих пор остается неизвестным. Несомненной его частью являются люциферазы, или ферменты, которые обеспечивают эту биолюминесценцию (т. е. высвобождение энергии в виде света). Копеподные люциферазы привлекают биологов своими уникальными свойствами, позволяющими их эффективно применять в качестве репортёрных белков в биомедицинских исследованиях.
На снимке и на видео - демонстрируется проявление биолюминесценции морских копепод Metridia sp.
Недавно красноярским ученым удалось клонировать гены, кодирующие люциферазу беломорского копеподного рачка Metridia longa. Этого представителя морского планктона отличает небольшой размер и способность к яркому свечению в случае угрозы вне зависимости от температуры воды. Клонирование генов люциферазы Metridia longa позволило получить рекомбинантные люциферазные белки для исследований в достаточных количествах. Биологи протестировали полученные люциферазные изоформы in vivo и in vitro, расшифровали и охарактеризовали молекулярный механизм яркого свечения.
В своей новой публикации (в рецензируемом научном издании Photochemistry and Photobiology (DOI: 10.1111/php.1307) сибирские исследователи систематизировали и критически оценили предыдущие экспериментальные данные, касающиеся основных структурных особенностей копеподных люцифераз и их люминесцентных и физико-химических свойств.
Лаборатория фотобиологии Института биофизики Федерального Научно-исследовательского центра «Красноярский научный центр СО РАН», возглавляемая одним из авторов статьи Евгением Степановичем Высоцким, давно занимается фундаментальными и прикладными исследованиями в области биолюминесценции, в том числе и морских организмов, и работает в тесном сотрудничестве с Сибирским федеральным университетом. Многие сотрудники лаборатории являются одновременно и преподавателями СибФУ, руководят работами студентов и аспирантов. Так, еще один из соавторов – бывшая аспирантка Сибирского федерального университета, а ныне научный сотрудник Института биофизики – Марина Дмитриевна Ларионова.
Как проходят научные поиски и какие проблемы решаются в исследовании, которым занимаются сотрудники в течение несколько лет, рассказала член авторского коллектива - Светлана Владимировна Маркова, кандидат биологических наук, доцент кафедры биотехнологии Сибирского федерального университета, старший научный сотрудник фотобиологической лаборатории Института биофизики Федерального научно-исследовательского центра «Красноярск научный центр СО РАН ». Она поделилась выводами проделанной работы по исследованиям люцифераз копепод, преимущественно из беломорского рачка Metridia longa.
Светлана Владимировна Маркова, кандидат биологических наук, доцент кафедры биотехнологии Сибирского федерального университета, старший научный сотрудник фотобиологической лаборатория Института биофизики Федерального научно-исследовательского центра «Красноярск научный центр СО РАН»
Как пояснила биолог, «большая часть статьи посвящена обзору разнообразных применений копеподных люцифераз в качестве биолюминесцентных репортеров, в том числе для мониторинга генной активности, оценки белок-белковых взаимодействий, для различных аналитических применений in vitro в качестве ферментной метки, для различных биоимиджинговых методов. Также рассмотрены варианты улучшения репортёрных свойств копеподных люцифераз путем мутагенеза и молекулярной эволюции». Кроме того, по замечанию Марковой, «наличие различных вариантов репортёров с различающимися свойствами обеспечивает необходимый выбор исследователю в зависимости от задач, условий и дизайна эксперимента».
Чем же привлекательна люцифераза беломорского рачка с точки зрения молекулярной биологии? Какими уникальными свойствами обладает этот представитель морских организмов?
«Планктонный беломорский копеподный рачок Metridia longa (размер до 1.5 мм) использует биолюминесценцию для защиты от хищников. В случае опасности он выстреливает ярко загорающуюся каплю-фантом и под ее прикрытием сбегает от ослепленного хищника. Испускаемая вспышка света при этом настолько яркая, что даже при дневном свете лаборатории исследователь обычно непроизвольно вздрагивает при попытке отловить ускользающего рачка в аквариуме. Это яркое свечение, как мы показали, обеспечивает маленький компактный белок – люцифераза, который рачок секретирует в морскую воду вместе с окисляемым субстратом – целентеразином. Секретируемая люцифераза Metridia longa представлена как минимум четырьмя типами неаллельных изоформ 16.5-22.2 kDa с немного различными свойствами. И, в частности, разные изоформы имеют разный температурный оптимум работы, – ответила Светлана Маркова и объяснила затем, - Все они синтезируется одновременно, так что рачок, который ежедневно мигрирует в дневное время с поверхности моря на дно, имеет наготове спектр люциферазных изоформ, покрывающих весь температурный диапазон и обеспечивающие яркое свечение независимо от температуры окружающей среды. Особенно интересна изоформа, наиболее эффективно работающая при 5°С. Это яркий пример адаптации организма на молекулярном уровне к быстро меняющимся условиям окружающей среды».
Люциферазы копепод вызывают большой интерес у биологов, но физико-химические свойства этих морских люцифераз мало изучены и зачастую опубликованные разными исследователями данные просто противоречивы. «Это обусловлено, скорее всего, тем, что этот маленький секретируемый белок имеет до 10 дисульфидных связей, которые должны правильно замкнуться для получения полностью функциональной структуры. Получение таких рекомбинантных белков в нативном виде (аналогичных природным) при использовании стандартных экспрессионных систем в клетках E.coli представляет очень сложную задачу. Как правило, препараты оказываются очень гетерогенными (в виде смеси молекул от полностью денатурированных до правильно свернутых в непредсказуемых сочетаниях), и, соответственно, могут иметь различные свойства. Нам удалось решить данную проблему, используя для получения правильно сформированных копеподных люцифераз более сложную эукариотическую экспрессионную систему в культивируемых клетках насекомых. Также нами было показано, что активность копеподных люцифераз сильно зависит от температуры, что часто не учитывалось в других работах», - прокомментировала Светлана Маркова.
По мнению российского ученого, «к сожалению, до сих пор неизвестно, что представляет собой природный белок копеподных люцифераз, поскольку для его исследований необходимо собрать в достаточном количестве биомассу, что почти невозможно в случае отдельных крошечных планктонных рачков. Наиболее исследованные на сегодняшний день первые клонированные люциферазы из копепод Gaussia princeps (GpLuc) и Metridia longa (MLuc) были выделены из кДНК библиотек по биолюминесцентной активности, которую эти гены придавали клеткам E.coli после внедрения». Клонирование генов этих люцифераз предоставило белки в достаточном количестве для их изучения и дало возможность использовать эти гены как генетически-кодируемые репортёры для различных биологических исследований. На основе этих идентифицированных последовательностей специалисты методом ПЦР (экспериментальным методом молекулярной биологии) идентифицировали аналогичные люциферазы и из других видов светящихся копепод.
Вообще, природа биолюминесцентной системы у морских организмов до конца не изучена и стоит на пути детального исследования. «Биолюминесценции или излучение видимого света живыми организмами в результате внутреннего биохимического процесса, являясь одним из базовых свойств живой клетки, до сих пор остается довольно загадочным явлением. Для многих организмов абсолютно непонятно, зачем им умение светиться, хотя из имеющихся генетических данных, очевидно, что это умение жестко поддерживается естественным отбором, - сказала Светлана Маркова и далее сообщила, - В процессе эволюции функция биолюминесценции возникала независимо в различных таксонах неоднократно и на базе совершено различных биохимических процессов в предковых организмах. На сегодняшний день известно уже более 40 биолюминесцентных систем, включающие совершенно различные биолюминесцентные ферменты и их субстраты. В последнее время исследования биолюминесценции были существенно расширены, поскольку белки биолюминесцентных систем, среди которых люциферазы, фотопротеины и флуоресцентные белки, оказались отличными репортёрами для молекулярных процессов в живых клетках. Легко регистрируемые в широком динамическом диапазоне световые сигналы позволяют проявить и в реальном времени отследить клеточные процессы, маркированные биолюминесцентными белками».
Клонированные природно-секретируемые люциферазы копепод совершенно не похожи на другие известные люциферазы, даже работающие с тем же субстратом, включая коралловую люциферазу Ренилла и люциферазу декаподных раков Oplophorus. Но высокая активность и стабильность копеподных люцифераз, включая термостабильность, позволяет ученым рассматривать их как очень перспективные репортёрные белки с широкой сферой применения. Как поясняет Маркова: «Некоторые исследователи даже называют копеподные люциферазы репортёрами следующего поколения. В основном сейчас в практике применяются первые клонированные гомологичные люциферазы GpLuc и MLuc из копепод Gaussia princeps и Metridia longa. Сразу же после клонирования эти люциферазы были успешно применены в качестве биолюминесцентных репортёров и с тех пор сфера их применения неуклонно расширяется».
Так, люциферазы копепод выступают как аналитический инструмент. Они широко используются как неинвазивный и нетоксичный метод в биовизуализации для мониторинга процессов в клетках организма. На основе этих люцифераз разработаны системы скрининга и мониторинга. Например, отслеживание передвижения иммунных клеток, рост метастазов опухолей, оценка количества опухолевых клеток по биолюминесцентной активности крови. Но здесь есть ограничения: животные могут проявлять иммунный ответ против люциферазы. Кроме того, синее свечение сильно поглощается пигментированными молекулами (гемоглобин и меланин).
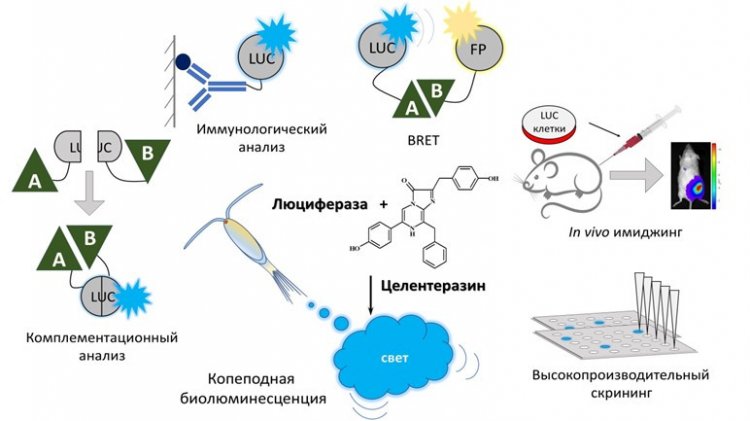
Схемы и основные области аналитического применения копеподных люцифераз: высокопроизводительный скрининг различных веществ, биолюминесцентный иммунологический анализ, биолюминесцентный имиджинг мелких животных in vivo после введения субстрата, детекция белок-белковых взаимодействий комплементационным анализом и методом безызлучательного резонансного переноса энергии (BRET). При комплементационном анализе неактивные фрагменты люциферазы, способные восстанавливать активность при пространственном сближении, присоединяются к различным белкам А и Б, их взаимодействии приводит к восстановлению активности люциферазы. В случае BRET, к исследуемым белкам присоединяют люциферазу и флуоресцентный белок (ФБ) – далее при взаимодействии белков А и Б люцифераза сближается с ФБ, который становится способным переизлучать ее свет, но с большей длиной волны, что влечет изменение цвета биолюминесценции.
Результаты, изложенные в обзорной научной статье, предполагают новые направления для будущей работы. По словам Марковой, сибирские учёные собираются «далее работать над установлением пространственной структуры копеподных люцифераз, а также над усовершенствованием их репортёрных свойств в различных направлениях, в том числе получение люцифераз со сдвинутым спектром в красную сторону для уменьшения поглощения света животными тканями и повышения чувствительности («окно прозрачности» биологических тканей ~600-1500 нм)».
Как отметила биолог: «Преимущественно планируем работать с наименьшей по размеру, но очень высокоактивной люциферазой 16.5 kDa из Metridia longa. Также планируется разрабатывать различные аналитические приложения для полученных новых репортёров на основе копеподных люцифераз».