Исследователи Сеченовского университета установили, что белок теплового шока HSP70 обладает значительным потенциалом для защиты нервных клеток при нейродегенеративных заболеваниях, таких как боковой амиотрофический склероз (БАС), болезнь Паркинсона и болезнь Альцгеймера. Результаты серии работ, опубликованных в ведущих международных журналах (включая Frontiers in Molecular Neuroscience, Applied Sciences и Laser Physics Letters), подтверждают нейропротективный эффект этого белка.
Нейродегенеративные заболевания, поражающие миллионы людей во всем мире, характеризуются прогрессирующей потерей функций и гибелью нервных клеток мозга. Эффективных методов остановки этого процесса в настоящее время не существует.
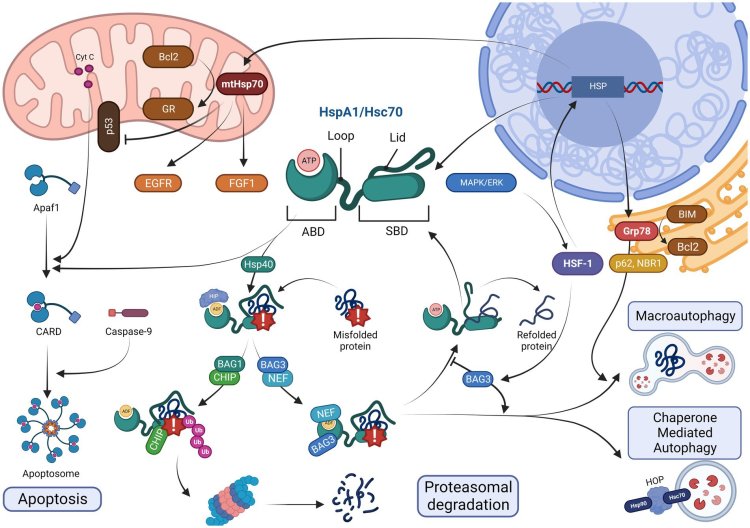
«Белки теплового шока, или heat shock proteins (HSP в аббревиатуре), массой 70 кДа, работают на своеобразном перекрестке множества механизмов, функционирующих в клетке. Но ключевая их роль заключается в защите клетки от поврежденных белков. Во-первых, они не позволяют новым белковым нитям запутываться в клубки, пока те не полностью готовы и не приняли свои правильные трехмерные структуры. Во-вторых, белки теплового шока, тратя на это довольно много энергии, устраняют белки, получившие повреждения: либо отвозят их на реутилизацию, либо разворачивают и удерживают, пока другие белки-ремонтники выполняют свою работу. Это основная роль белков теплового шока. Свое применение они находят в различных областях биомедицины, в частности, при нейродегенеративных заболеваниях, но имеется и хорошая перспектива их использования в онкологии. Сейчас прорабатываются проекты по исследованию белков теплового шока при различных повреждениях кожи, кожных ранах, других воздействиях. То есть спектр применения этих белков действительно достаточно широкий», — отметил в разговоре с корреспондентом «Научной России» к.м.н., доцент кафедры анатомии и гистологии человека Института клинической медицины им. Н. В. Склифосовского Геннадий Александрович Пьявченко.
Г.А. Пьявченко
В ходе многолетних исследований команда изучала влияние повышенного производства белка HSP70 (конкретно формы HSPA1A) на развитие нейродегенерации у трансгенных мышей. В одном из последних экспериментов использовались мыши с моделью FUS-ассоциированного нейродегенеративного процесса — одной из форм болезни, схожей с БАС у человека. Было обнаружено, что избыток HSP70 помогает нервным клеткам справляться с накоплением патологических белков, предотвращая их слипание (агрегацию) и защищая нейроны от гибели. Белок поддерживает протеостаз — жизненно важный клеточный баланс синтеза, правильного сворачивания и утилизации белков, особенно в условиях стресса или болезни.
«В научной литературе мы и наши коллеги всегда указываем, что у животных изучалась гиперэкспрессия, гиперпродукция белков теплового шока на моделях животных, например, с болезнью Альцгеймера. То есть это моделирование близкого состояния. Полностью перенести болезнь животного на человека невозможно по многим причинам: от различий в количестве хромосом и развитии патологий до фундаментальных законов эволюции, генетики и жизни. Поэтому мы говорим не о нейродегенеративных заболеваниях человека или животных как таковых, а об их моделях. Однако в нашем конкретном случае эти модели весьма близки. Мы изучаем не мышиные белки, подобные человеческим HSP. Мы изучаем именно человеческие белки, гены которых перенесены в организм мыши. Это, наверное, сейчас максимально возможное приближение на данном этапе развития науки», — подчеркнул Г.А. Пьявченко.
Введение рекомбинантного HSP70 мышам в дозах до 500 мкг/кг не вызывало выраженных структурных изменений в тканях мозга, печени, селезенки или тимуса. Это дает основания предполагать безопасность системного применения. Однако критически важна локализация белка: внутриклеточный HSP70 защищает нейроны, тогда как внеклеточный может усиливать повреждение. Исследователи также разработали и применили передовые методы анализа, включая количественное иммунофлуоресцентное картирование и рамановскую спектроскопию с использованием машинного обучения.
«В наших экспериментах мы исследуем животных с повышенной внутриклеточной экспрессией, или продукцией, белков теплового шока. Любое вещество в живой системе должно находиться на своем месте. То, что хорошо внутри клетки, может навредить вне ее. Организм вполне логично обычно считает молекулы белков теплового шока, попавшие вне клеток, сигналом о повреждении, запуская тревожную сигнализацию — иммунные реакции. Впрочем, в реальности все чуточку сложнее. Одни и те же клетки в различных условиях будут иметь разную восприимчивость к белкам теплового шока, и при попадании белка на их поверхности сигнализация не всегда работает одинаково. Это сложный процесс, но действительно в разных ситуациях эффекты белков теплового шока при разной локализации или при воздействии на разные клетки-мишени могут быть абсолютно разными. Изучение этих тонких механизмов при различных патологиях и на разных клетках-мишенях — одна из основных задач наших исследований», — объяснил ученый.
Эксперименты показали снижение уровня нейродегенерации в различных областях мозга мышей, включая не только спинной мозг и кору, но и лимбическую систему, ответственную за эмоции и поведение. Это указывает на потенциальную возможность сохранения когнитивных функций.
«Остается много вопросов. И, как правило, чем больше мы получаем ответов, тем больше дополнительных мини-вопросов, деталей, подробностей возникает, скажу честно. Но мы их решаем. И решаем не только мы, но и коллективы по всему миру, как и в России. То есть это большая глобальная цель по поиску различных способов коррекции, в нашем случае нейродегенеративных заболеваний, с помощью белков теплового шока. Сейчас, если очень кратко: мы подняли вопросы, действует ли повышенная экспрессия HSP на нейропротекторное воздействие, замедляет ли она нейродегенерацию? Мы получили однозначный ответ и показали в наших экспериментах, что да. Тогда возникает следующий вопрос: либо надо как-то активно и стандартизированно вызывать повышенную экспрессию этих белков теплового шока в организме человека или животных, либо надо думать о способах доставки самих этих белков теплового шока. И как мы видим в наших исследованиях, доставлять их нужно внутрь клетки, а не вне клетки. Как это наиболее эффективно сделать нам еще предстоит выяснить», — подвел итог Г.А. Пьявченко.
Данные исследований, хотя и полученные пока на доклинических моделях, открывают значительные перспективы для разработки новых терапевтических стратегий, направленных на активацию защитных функций белков HSP70 для борьбы с нейродегенеративными заболеваниями.
Новость подготовлена при поддержке Министерства науки и высшего образования РФ
Источник фото на странице: Frontiers in Molecular Neuroscience