Сотрудники лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН разрабатывают подходы для рационального дизайна антител на примере антитела против вируса клещевого энцефалита.
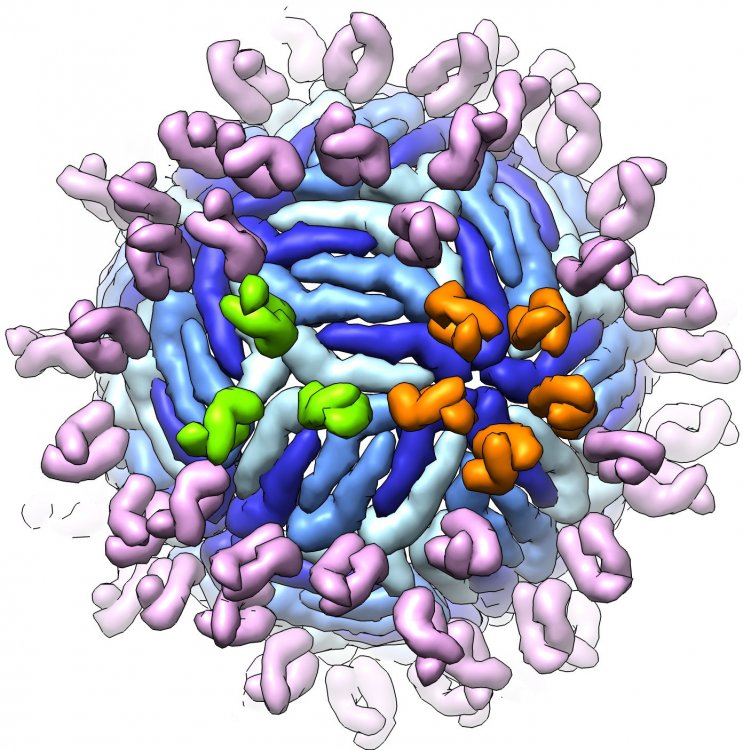
Вирион вируса клещевого энцефалита, с которым связаны фрагменты антител.
Ранее данное антитело показало высокую эффективность в экспериментах на животных по отношению к трем основным субтипам вируса: дальневосточному, сибирскому и европейскому. Вместе с тем, на основе экспериментов с рекомбинантными вирусными белками исследователи предположили, что есть потенциал по оптимизации структуры антитела для более прочного связывания с сибирским и европейским субтипами вируса.
Специфический сывороточный иммуноглобулин, который обычно вводят тем, кого укусил клещ, может вызывать аллергические реакции и биологически небезопасен. Ранее ученые из ИХБФМ СО РАН разработали химерное антитело против вируса клещевого энцефалита, которое не имеет таких недостатков и уже прошло испытания на животных. Клиническими исследованиями занимается индустриальный партнер института — АО «Фармасинтез».
Есть три основных разновидности (субтипа) вируса клещевого энцефалита: дальневосточный, сибирский и европейский. Исходное мышиное моноклональное антитело было получено с использованием дальневосточного субтипа, затем на его основе исследователи создали химерное антитело. По словам научного сотрудника ИХБФМ СО РАН кандидата химических наук Ивана Константиновича Байкова, параллельно с работой по созданию штамма-продуцента химерного антитела и исследованием противовирусных свойств этого антитела на животной модели ученые изучали молекулярные особенности механизма действия антитела: определили пространственную структуру комплекса антитела с фрагментом вирусного белка, а также исследовали прочность связывания антитела с фрагментами вирусного белка различных субтипов. Оказалось, что с сибирским и европейским вариантами белка антитело связывается несколько менее прочно, чем с дальневосточным. Однако, подчеркивает Иван Байков, это не означает более низкой эффективности антитела по отношению к этим субтипам вируса: в экспериментах на животных не было обнаружено существенной разницы между субтипами, антитело одинаково хорошо проявляло протективную активность на всех исследованных штаммах.
«Химерное антитело, созданное нами ранее, эффективно нейтрализует вирус и защищает животных от клещевого энцефалита. И оно прекрасно подходит для создания лекарства. Однако мы надеемся, что если удастся оптимизировать связывающий центр антитела и повысить сродство к вирусным белкам сибирского и европейского штаммов, то такие оптимизированные антитела, вероятно, будут обладать еще более высокой защитной активностью. С производственной и потребительской точки зрения это означает введение более низких доз препарата антитела для достижения той же эффективности. В этом проекте мы не ставим цель сделать новое антитело для создания нового лекарства. В том числе и потому, что это потребует новых вложений в проведение доклинических средств и создание штамма-продуцента. То, что мы пытаемся сейчас сделать в рамках проекта, — это разработать подходы, с помощью которых, анализируя пространственные структуры, далее осуществлять рациональный дизайн антител и улучшать их свойства. Тут возможно несколько подходов. Одно дело, когда мы что-то меняем в антителе навскидку, не зная структуры, и смотрим на результат. Это не рациональный дизайн, а скорее случайный перебор. Мы же в рамках молодежного гранта РНФ (№ 19-74-00107) пытаемся модифицировать данное антитело методами белковой инженерии не вслепую, а на основе структурных данных и данных молекулярной динамики. И затем смотрим, улучшаются ли свойства модифицированных вариантов», — уточняет Иван Байков.
Что касается различий в прочности связывания с белками разных субтипов вируса клещевого энцефалита, то «…есть предположение, это вызвано тем, что дальневосточный вариант вирусного белка содержит в определенном участке своей поверхности более компактный аминокислотный остаток, который хорошо стыкуется с поверхностью антитела, в то время как сибирский и европейский варианты вирусного белка содержат в этом же положении более объемный аминокислотный остаток. Если посмотреть на пространственную структуру комплекса, это достаточно хорошо видно», — объясняет Иван Константинович.
На данный момент удалось создать около десятка различных мутантных вариантов антитела. Самый лучший из них связывается с сибирским и европейским вариантами вирусного белка в два раза более прочно по сравнению с исходным антителом. При этом к дальневосточному варианту вирусного белка сродство снизилось. Это было ожидаемо, потому что структуру антитела подогнали под европейский и сибирский варианты вирусного белка, а значит, отдалились от дальневосточного.
Есть несколько способов получения структуры белковых молекул: рентгеновская кристаллография, криоэлектронная микроскопия и ядерно-магнитный резонанс. В первом из способов кристаллы белка или белкового комплекса помещают в пучок рентгеновского излучения (на синхротроне или лабораторном дифрактометре). «Интенсивность на синхротроне более высокая, на сбор данных уходит гораздо меньше времени (буквально минуты, для некоторых установок даже секунды). Однако у рентгеновской кристаллографии есть “узкое горлышко”: получение белковых кристаллов. Чтобы закристаллизовать белок, нужно создать необходимые условия: во-первых, обеспечить высокую концентрацию белка, чтобы молекулам было удобнее находиться не в растворе, а образовать кристаллическую решетку. Во-вторых, нужно подобрать правильное значение pH, обеспечить наличие тех или иных солей, стабилизирующих межмолекулярные связи», — рассказывает исследователь.
Структура комплекса между антителом против вируса клещевого энцефалита и вирусным белком была получена на источнике синхротронного излучения PETRA III комплекса DESY (Гамбург, Германия) совместно с коллегами из Германии и Чехии. Использование синхротронов необходимо для того, чтобы получать пространственную структуру белковых молекул и узнавать, что происходит у них внутри. Грубо говоря, это как большой микроскоп, с помощью которого можно изучать то, как упакованы атомы белка и его аминокислотные остатки, с тем чтобы в дальнейшем принимать решения, что и как менять в этом белке. «После того как мы получили тот или иной вариант антитела, мы анализируем изменение сродства к вирусным белкам различных субтипов и отбираем лучшие варианты. Далее мы можем закристаллизовать этот комплекс и определить его структуру с помощью источника синхротронного излучения, например СКИФа, чтобы в деталях увидеть строение интересующей нас области», — говорит Иван Байков.
«Проблема отсутствия источника синхротронного излучения поблизости не в том, что трудно попасть на зарубежные установки, — добавил ученый. — Дело в том, что есть привязка к жесткому графику: вы пишете заявку, вам дают время, обычно это происходит один-два раза в год. А если синхротрон находится рядом, там не слишком большая очередь и вы имеете к нему доступ, всё гораздо проще, инструмент у вас под руками. Наличие СКИФа поблизости, безусловно, облегчит такого рода исследования».
Мария Фёдорова
Информация и фото предоставлены Управлением по пропаганде и популяризации научных достижений СО РАН