Группа учёных из российских университетов представила новый подход к уничтожению опухолей с помощью наночастиц. В исследовании принял участие профессор Центра медицинской химии Тольяттинского государственного университета (ТГУ) Дмитрий Хоченков.
Основной подход к лечению опухолей связан с применением химиотерапевтических препаратов или хирургическим удалением опухоли. При введении в организм человека химиопрепараты разносятся по всему телу, действуя не только на раковые клетки, но и на здоровые ткани. Это является серьёзной проблемой лечения, в связи с чем всё большую популярность в современной медицине приобретает перспектива уничтожения поражённых клеток путём локальной гипертермии. Уже созданы и применяются различные технологии и устройства термического разрушения повреждённых тканей за счёт нагревания различными физическими факторами.
Исследование, в котором принял участие профессор Центра медицинской химии Тольяттинского государственного университета Дмитрий Хоченков, основано на тераностике – новом медицинском подходе, заключающемся в создании препаратов, которые одновременно могут обеспечивать и терапию, и диагностику заболевания. Одно из направлений тераностики – создание наночастиц, обладающих уникальными оптическими свойствами (ап-конверсией), которые способны связывать раковые клетки и уничтожать их при помощи активации фотосенсибилизатора* или локального действия высокой температуры.
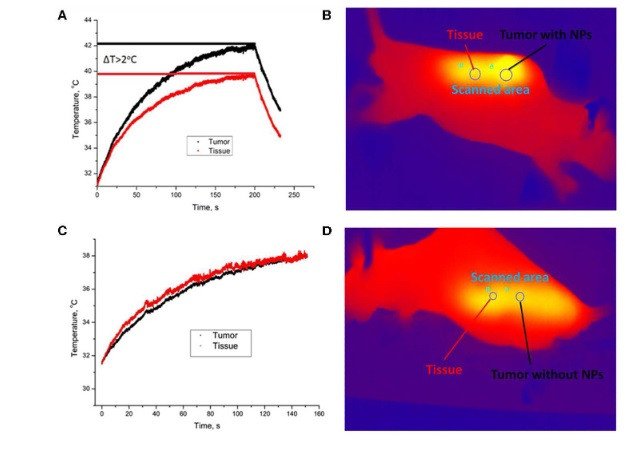
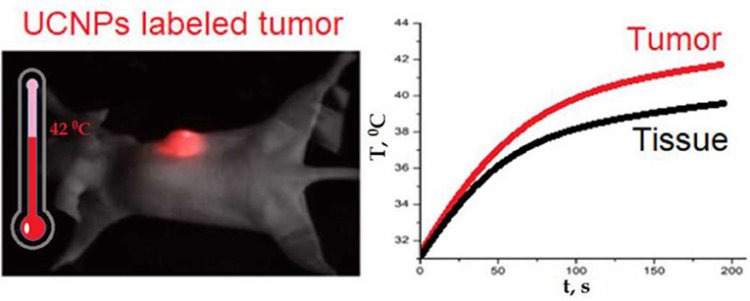
– Основная идея исследования заключается в следующем. Наночастицы вводятся в организм, а так как у повреждённой ткани повышена проницаемость сосудов, то наночастицы скапливаются в опухолевом очаге. При облучении опухоли, накопившей наночастицы, лазером с длиной волны 975 нм, температура в опухоли будет несколько выше, чем в окружающих тканях. С точки зрения обывателя, разница незначительна – всего 2 градуса. Но когда температура превышает 42 градуса, в месте облучения начинается процесс термоабляции** – модификации либо уничтожения повреждённых клеток. При этом окружающие опухоль здоровые ткани не затрагиваются, – рассказал Дмитрий Хоченков.
В научную коллаборацию под руководством кандидата физико-математических наук, старшего научного сотрудника ФНИЦ «Кристаллография и фотоника» РАН Евгения Хайдукова вошли 11 специалистов, представляющих Институт молекулярной биологии им. В.А. Энгельгардта РАН, Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, Институт тонких химических технологий имени М.В. Ломоносова, Сеченовский Университет, Тольяттинский государственный университет.
– Работа с такими объектами, как наночастицы, требует большого коллектива, – поясняет Дмитрий Хоченков. – Одни создают саму частицу, другие наносят полимерные покрытия, обеспечивающие ей долгую жизнь в организме, третьи проводят диагностику и т.д. Пока слишком рано говорить о новом способе лечения – есть ещё много вопросов, связанных с определением эффективности, токсичности, возможной высокой стоимостью данного метода. Но с уверенностью можно говорить о том, что наше исследование сформировало прототип нового подхода к механизмам термоабляции.
Результаты своих исследований учёные опубликовали в престижном научном журнале «Frontiers of chemistry» (https://www.frontiersin.org/articles/10.3389/fchem.2020.00295/full). Журнал индексируется в Scopus – одном из самых авторитетных собраний библиографических и реферативных научных материалов в мире.
*Фотосенсибилизатор – природное или искусственно синтезированное вещество, способное к фотосенсибилизации биологических тканей, то есть увеличению их чувствительности к воздействию света.
**Термоабляция (абляция; от латинского ablatio) – это методика прямого направленного разрушения ткани, которое достигается путем термического либо химического/электрохимического воздействия.
Информация и фото предоставлены пресс-службой ТГУ