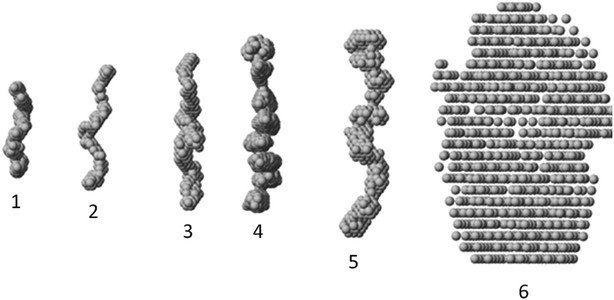Исследователи НИЦ «Курчатовский институт» совместно с коллегами из Института регенеративной медицины Сеченовского Университета и ФНИЦ «Кристаллография и фотоника» РАН впервые провели комплексный анализ структуры белка фибрина и его модификаций, применяющихся в тканевой инженерии. Полученные данные позволят ученым создавать более совершенные тканевые импланты, в которых процесс роста сосудов будет осуществляться направленным образом. Результаты этого исследования были опубликованы в журнале RSC Advances.
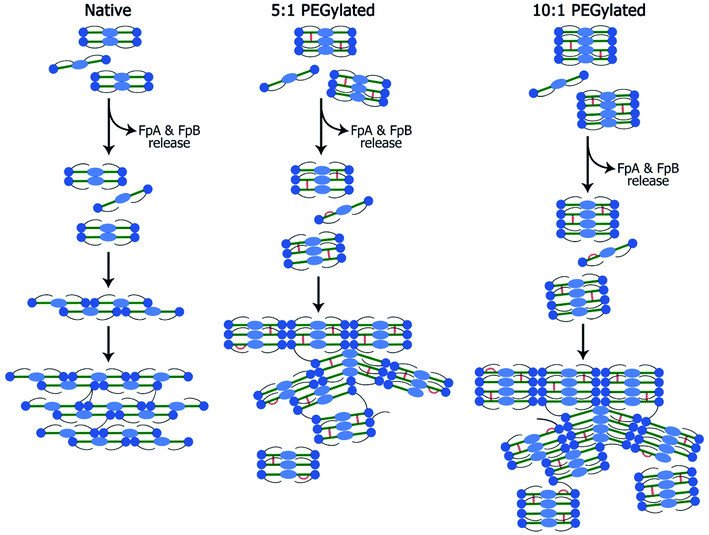
Одна из сложнейших задач тканевой инженерии – запустить в импланте процесс формирования сосудов, которые обеспечивали бы доставку питательных веществ и кислорода, а также удаление продуктов метаболизма. Белок крови фибрин и его модификации часто используют при разработке имплантов, чтобы создать условия для будущего роста кровеносных сосудов. В данной работе ученые впервые выяснили, как меняется структура белка при его модификации, и какие структурные особенности обуславливают наиболее эффективный рост капилляров.
«Известно, что модификация фибрина с помощью функционализированного полиэтиленгликоля улучшает ряд свойств, необходимых для успешного приживления импланта. Стоящие за этим механизмы мы и решили изучить», - пояснила инженер-исследователь отдела структурной биологии Курчатовского комплекса НБИКС-природоподобных технологий НИЦ «Курчатовский институт» Алёна Крюкова.
Ученые сравнили пространственную организацию белка до и после его модификаций. Соединение, где на одну молекулу фибрина приходятся 5 молекул полиэтиленгликоля, обладало наилучшими характеристиками для формирования капилляроподобных структур.
«Мы показали, что из-за особой пространственной организации данного соединения, его использование в инженерии тканей и органов улучшает миграцию клеток и формирование просвета в образуемых ими трубчатых структурах», - пояснил сотрудник отдела структурной биологии Курчатовского комплекса НБИКС-природоподобных технологий НИЦ «Курчатовский институт» Пётр Конарев. По словам ученого, исследование стало возможным благодаря комплексному физико-химический анализу, включившему такие методы, как малоугловое рентгеновское рассеяние, инфракрасная спектроскопия, конфокальная лазерная и электронная сканирующая микроскопия, термогравиметрия и атомно-силовая микроскопия.
Результаты исследования станут основой для подбора биоматериалов, которые позволят осуществлять инженерию тканей и органов на новом уровне. Импланты будут содержать предварительно сформированную капиллярную сеть. Для их создания ученые планируют использовать возможности трехмерной биопечати.
Работа поддержана грантом РНФ.
Справочно:
Процесс свертывания крови в организме происходит при воздействии фермента тромбина на белок крови фибриноген, в результате чего образуется полимерный белок фибрин. Специалисты по тканевой инженерии получают фибриновый гель тем же способом. Модификация фибринового геля с помощью функционализированного полиэтеленгликоля позволяет достигнуть прозрачности геля, улучшить его стабильность и, что самое важное, создать благоприятные условия для формирования капилляроподобной сети.