Ученые разработали модель для прогнозирования выживаемости пациентов с аденокарциномой легких — самой распространенной формой рака легких, — опираясь на данные об уровне белков, которые контролируют качество митохондрий — «энергетических станций» клетки. Разработка поможет наиболее точно на сегодняшний день оценивать состояние пациентов и подбирать эффективное лечение. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Cell Death Discovery.
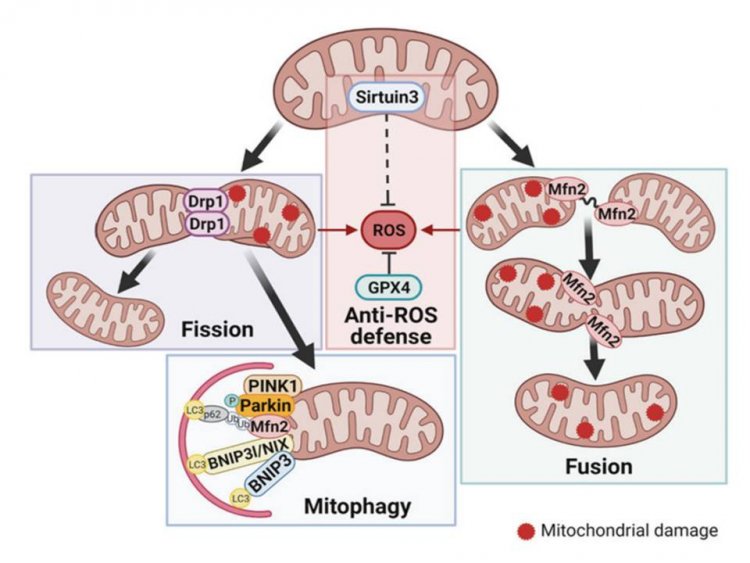
Взаимосвязь между белками-регуляторами митофагии, деления и слияния митохондрий, а также антиоксидантной защиты, включенными в анализ. Источник: Анна Горбунова
Митохондрии — «энергетические станции» клетки — обеспечивают дыхание и нормальное функционирование (гомеостаз) всех клеток и тканей нашего организма. При нарушении их работы возникают различные патологические процессы. Так, в легких, как и в других тканях, дисфункция митохондрий может привести к хроническим заболеваниям и раку. Поэтому в клетках существуют механизмы, поддерживающие число, качество и работоспособность «энергетических станций». Они, в свою очередь, управляются специальными регуляторными белками. Следовательно, по уровню этих молекул в клетках можно оценить, нормально ли идут процессы, или же функции митохондрий нарушены. Так, если тех или иных белков-регуляторов слишком мало или много, либо меняется их соотношение, можно предполагать нарушение в работе «энергетических станций».
Сотрудники Института молекулярной биологии имени В.А. Энгельгардта (Москва) и Московского государственного университета имени М.В. Ломоносова (Москва) оценили уровень белков, контролирующих качество митохондрий, в нормальной и в опухолевой ткани у 80 пациентов с аденокарциномой легкого. Этот подтип рака легких, как правило, встречается у некурящих людей и обычно диагностируется достаточно поздно, из-за чего успех лечения во многом зависит от правильного прогнозирования.
Авторы включили в анализ белки, отвечающие за митофагию (BNIP3, NIX, PINK1 и Parkin). Они привлекают к нефункциональным митохондриям аутофагосомы — внутриклеточные «устройства» для переваривания продуктов жизнедеятельности. Еще один белок — DRP1 — отделяет поврежденные митохондрии от нормальных, чтобы отправить на переваривание только первые. Кроме того, ученые рассмотрели белок MFN2, который участвует в противоположном процессе — слиянии митохондрий. Как правило, оба процесса, митофагия и динамика митохондрий, поддерживают здоровую популяцию этих внутриклеточных телец и предотвращают накопление активных форм кислорода.
«Биохимический анализ здоровых и опухолевых тканей показал, что в раковых клетках до двух раз повышен уровень белков митофагии. Это говорит о том, что в данном случае слишком много митохондрий нарушено и активнее идут процессы по их удалению», — поясняет участник проекта, поддержанного грантом РНФ, Анна Горбунова, один из авторов статьи, кандидат биологических наук, научный сотрудник факультета фундаментальной медицины МГУ имени М.В. Ломоносова.
На основании полученных молекулярных данных, а также информации о возрасте, поле и стадии заболевания пациентов, авторы построили прогностическую модель, которая оценила шансы больных прожить последующие год, три и пять лет. Используя математические методы, исследователи доказали, что точность прогнозирования у новой модели на 20% превышает имеющиеся в настоящее время модели. Для сравнения, прогнозы, в которых учитывается только стадия опухоли, имеют значительно более низкую вероятность. Таким образом, предложенный подход позволит врачам эффективнее прогнозировать исход болезни и персонализировать лечение пациентов с аденокарциномой легких.
«Нам удалось разделить пациентов на разные группы риска и спрогнозировать их выживаемость. Модель продемонстрировала значительно лучшую прогностическую ценность, чем другие известные модели, построенные, например, только с учетом стадии опухоли. В дальнейшем мы планируем расширить нашу модель с добавлением новых маркеров, а также дополнительно проверить ее, включив в анализ значительно большее число пациентов», — рассказывает участник проекта, поддержанного грантом РНФ, Алексей Замараев, научный сотрудник Института молекулярной биологии имени В.А. Энгельгардта и лаборатории исследования механизмов апоптоза МГУ имени М.В. Ломоносова.
Информация и фото предоставлены пресс-службой Российского научного фонда