Нижегородские химики успешно работают над созданием новых материалов, способных значительно расширить возможности и эффективность фотодинамической тeрапии онкологических заболеваний (ФДТ). Этот вид терапии, как известно, широко применяется для лечения некоторых видов рака, и основан он на возбуждении светом введенных в опухоль соединений-красителей (фотосенсибилизаторов), которые в процессе такого возбуждения генерируют коротко-живущие цитотоксичные частицы, в особенности т.н. синглетный кислород, приводящий к быстрой гибели раковых клеток. Важно отметить, что проблема осуществления прямого контроля процесса ФДТ, который позволил бы в режиме реального времени отслеживать фотодинамическое воздействие на опухоль и снизить неблагоприятные побочные явления, по сей день является важнейшим вызовом современной онкологии. Только такой контроль может обеспечить каждому пациенту строго индивидуализированный подход к выбору оптимального режима ФДТ (продолжительность и доза фотооблучения, учет специфики «отклика» опухоли на световое воздействие и т.д.).
В ИМХ РАН разработан ряд соединений на основе флюоресцентных цианопорфиразиновых красителей, которые, возможно, знаменуют собой появление совершенно нового поколения фотосенсибилизаторов. Эти соединения сочетают способность генерировать при фотовозбуждении синглетный кислород, основной эффектор ФДТ, с аномально высокой зависимостью их фотофизических характеристик (квантового выхода и времени жизни флюоресценции) от вязкости окружающей среды. Недавно английскими учеными было установлено, что процесс ФДТ сопровождается значительным возрастанием внутриклеточной вязкости. Это позволяет всерьёз надеяться, что полученные новые фотосенсибилизаторы, демонстрирующие высокую вязкостную чувствительность параметров флюоресценции, могут быть использованы в качестве флюоресцентных зондов, отслеживающих изменение вязкостных свойств раковых клеток в процессе ФДТ. Другими словами, открывается возможность простого и неинвазивного (без инструментального проникновения внутрь организма) мониторинга фотодинамического процесса в режиме реального времени по изменению параметров флюоресценции фотосенсибилизатора. По сути дела, речь идет о создании новой технологии тераностики (объединения терапевтического и диагностического подходов). В настоящее время нижегородские биофизики, получили возможность протестировать образцы таких уникальных фотосенсибилизиторов ФДТ на раковых клетках и опытных животных. В дальнейшем, в случае удачных пре-клинических исследований, за дело готовы взяться практикующие клиницисты-онкологи.
«А начиналось все с получения чрезвычайно интенсивно окрашенного вещества зеленого цвета, которое у нас неожиданно образовалось при выполнении плановых исследований по получению нелинейно-оптических материалов, – рассказала кандидат химических наук Лариса Григорьевна Клапшина, старший научный сотрудник той самой лаборатории ИМХ РАН, в которой соединения были получены. – Это вызвало у нас большой интерес, и мы стали вещество анализировать. Исследования показали, что впервые использованный нами оригинальный синтетический подход позволил получить совершенно новые соединения порфиразинового ряда. Результаты нами были опубликованы в 2007 году в высокорейтинговом журнале Британского химического общества «Chemical Communications. Введение в структуру красителя ароматических групп привело к возникновению интенсивной красной флуоресценции, причем, особенно сильно этот эффект проявлялся в органическом стекле – образец просто сиял!
Мы показали образцы наших соединений специалистам по биофотонике. Группа ведущих ученых из ИПФ РАН, Медицинской академии и биологического факультета ННГУ проводили тогда апробацию метода флуоресцентного биоимджинга на приборах, созданных в ИПФ РАН, с использованием фотосенсибилизаторов ФДТ, известных в клинике. Однако, им было интересно оценить возможности нового прибора в тестировании новых потенциальных противораковых препаратов. Для таких экспериментов требовались водорастворимые формы вещества.
Поэтому потребовалось некоторое время на разработку стабильных водных наносуспензий, на основе наночастиц различных нетоксичных водорастворимых полимеров, включающих молекулы наших красителей. Проведя испытания на живых организмах (опытных мышах, несущих модельные раковые опухоли) биофизики Балалаева И.В. и Ширманова М.В. дали заключение, что наше соединение способно избирательно накапливаться в раковой опухоли. При этом, благодаря флуоресцентным свойствам красителя, удалось осуществить детектирование опухолевой ткани на теле животного, что в дальнейшем позволит осуществлять прицельную ФДТ. Важно отметить, что из-за нарушения лимфо-дренажной системы для раковой опухоли характерно патологическое разрастание системы кровеносных сосудов, увеличение их плотности и размеров. Чем сильно отличает раковую ткань от нормальной. Однако, именно это открывает возможность использовать полимерные наночастицы определенного размера, содержащие противораковый препарат, способные, как в губке, селективно накапливаться в раковой опухоли. Нам удалось подобрать оптимальный размер полимерных наночастиц и исследования биологов Балалаевой И.В. и ее аспирантки Шилягиной Н.Ю. подтвердили, что наше соединение способно легко проникать в раковую клетку и при возбуждении светом с определенной длиной волны генерировать внутри нее синглетный кислород»
И все же, для Л.Г. Клапшиной и ее коллег по-прежнему оставался загадкой тот факт, что полученные красители, демонстрирующие яркое красное свечение в органическом стекле, давали чрезвычайно слабый сигнал флуоресценции в растворах. Особенно удивительным было то, что в водной среде, содержащей протеины крови, интенсивность флюоресценции вновь возрастала 100-200 раз.
«Мы тогда еще не знали, что наши порфиразиновые красители относятся к классу флюоресцентных молекулярных роторов - призналась Лариса Григорьевна. – Помогла одна встреча. В 2011 году на VI съезде Российского фотобиологического общества мне довелось услышать доклад в разделе Биомедицинские приложения фотофизики и фотохимии «Вязкость в клетках от молекулярных роторов до фотодинамической терапии». Его делала исследователь из Великобритании (Chemistry Department Imperial College) Марина Константиновна Куимова (выпускница МГУ). Доклад меня очень заинтересовал и мы познакомились.
М.К. Куимова с 2008 года занимается изучением фотофизических свойств красителей, принадлежащих к классу т.н. флуоресцентных молекулярных роторов. Термин «роторы» связан с особенностью фотофизического поведения таких молекул, а именно, с внутримолекулярным вращением одной части молекулы относительно другой под действием квантов света. Ясно, что в высоковязких средах такое вращение затруднено и почти вся энергия светового возбуждения расходуется молекулой только на флуоресценцию, поэтому ее интенсивность сильно растет. Именно это позволило использовать соединения-роторы в качестве зондов вязкости, в том числе и внутриклеточной. М.К Куимова стала первым исследователем, установившим, что в процессе фотодинамической смерти раковых клеток сильно нарастает внутриклеточная вязкость. В 2009 году результаты ее исследований был опубликован в журнале серии Nature, что можно рассматривать как свидетельство особой важности и новизны научного материала. В работе было высказано предположение, о том, что соединение, сочетающее свойства фотосенсибилизатора ФДТ и флюоресцентного молекулярного ротора, могут быть использованы для мониторинга динамических процессов в раковых клетках при их фотоиндуцированной смерти. Это было показано на примере уникального порфиринового димера сложного строения, впервые полученного учеными Оксфорда. Однако, широкие исследования с использованием этого макроциклического димера были весьма затруднены в связи с высокой сложностью его синтеза и очень низким выходом целевого продукта.
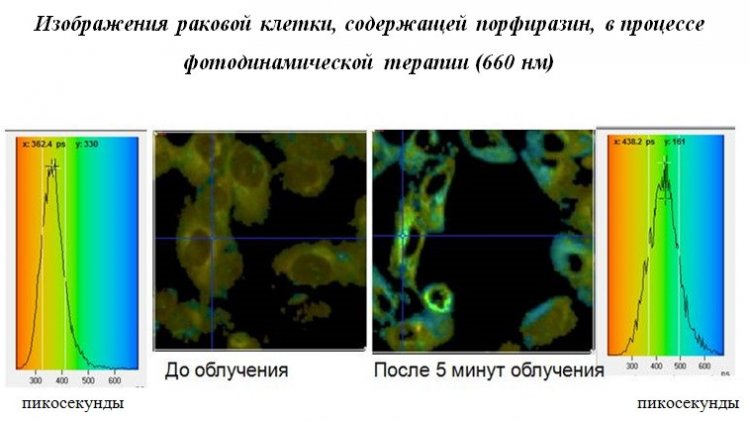
Мы рассказали о необычных фотофизических свойствах наших порфиразиновых красителей, а также о результатах полученных биологами, и Марина предложила нам исследовать зависимость люминесценции наших соединений от вязкости. В том же 2011 году мы начали наше сотрудничество и получили подтверждение тому, что наши порфиразиновые красители являются не только фотосенсибилизаторами ФДТ, но и флюоресцнтными молекулярными роторами. Позднее в Лондоне в совместном эксперименте на раковых клетках, включающих в себя порфиразиновый фотосенсибилизатор, нам удалось наблюдать в режиме реального времени их фотоиндуцированную гибель. Мониторинг осуществлялся с помощью метода FLIM (флуоресцентный биоимиджинг с функцией временного разрешения) по изменению времени жизни флюоресценции нашего «ротора», вызванное увеличением внутриклеточной вязкости раковых клеток в процессе ФДТ. Таким образом, разработанные нами красители являются вторым известным примером уникального сочетания свойств молекулярного ротора и фотосенсибилизатора ФДТ, что придает им особую значимость. При этом существенным преимуществом российских фотосенсибилизаторов-роторов является их доступность: простота и дешевизна синтеза, а также высокие выходы целевых продуктов».
Второй этап исследований порфиразиновых фотосенсибилизаторов-роторов предполагается осуществить с использованием установки FLIM, созданной на базе ИПФ РАН под руководством члена корреспондента РАН А.М. Сергеева, д.ф-м.н. Следует отметить, что такие исследования впервые будут проводиться in vivo, т.е. на опытных животных. Планируется также использовать серийный прибор FLIM, произведенный в США, которым располагает лаборатория биоимиджинга при НижГМА под руководством проф. Е.В.Загайновой.
В команду исследователей войдут ведущие нижегородские ученые: химики-органики, биофизики, специалисты по лазерной спектроскопии и медики-клиницисты из ИПФ РАН, НижГМА и ННГУ.
Источник фото превью и изображения: Вестник Нижегородского научного центра РАН























