Биологи МГУ имени М.В. Ломоносова совместно с зарубежными коллегами описали механизм, с помощью которого раковые клетки избегают гибели. Оказалось, что недостаток кислорода нарушает синтез белков, которые в нормальных условиях убивают опухоль. Это открытие поможет разработать лекарства, способные «обойти» систему выживания злокачественных клеток. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Chemico-Biological Interactions.
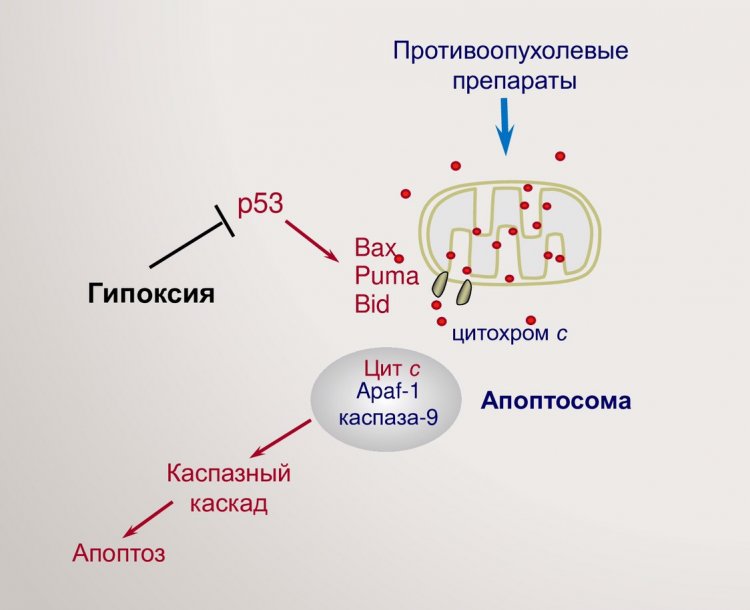
Механизм, с помощью которого раковые клетки избегают гибели при недостатке кислорода. Источник: Владимир Гогвадзе
Человеческий организм избавляется от клеток, в ДНК которых накопилось слишком много случайных мутаций, с помощью программируемой клеточной гибели — апоптоза. Этот процесс самоуничтожения запускают специальные проапоптотические белки из семейства Bcl-2, которые образуют отверстия (поры) в оболочке митохондрий — «энергетических станций» клетки. Это приводит к тому, что через такие поры из митохондрий в цитоплазму выходит белок цитохром с. Он формирует комплекс с другими белками, активируя ферменты, непосредственно убивающие клетку.
Апоптоз интересен тем, что с его помощью можно бороться с раковыми клетками, если заставить их убивать самих себя. Однако ученые установили, что большинство опухолей развивается в условиях гипоксии, то есть в местах, в которые из-за недостаточного кровоснабжения поступает мало кислорода. Кислород необходим клеткам для окислительных реакций и выработки энергии в митохондриях, а если его слишком мало, эти процессы нарушаются. Кроме того, из-за нехватки кислорода митохондрии становятся устойчивыми к белкам, которые создают в них поры, а значит, и к апоптозу. Однако до сих пор не было понятно, какой именно механизм помогает раковым клеткам избегать самоуничтожения при гипоксии, поэтому научная группа из Московского государственного университета имени М.В. Ломоносова (Москва) с коллегами из Каролинского института (Стокгольм) провела исследование, чтобы ответить на этот вопрос.
Биологи смоделировали условия гипоксии для клеток опухолей кишечника и легких. Раковые клетки культивировали в условиях гипоксии либо обрабатывали химическим веществом, которое действовало на них таким же образом, как и недостаток кислорода. Эксперимент показал, что это вызвало уменьшение количества белков семейства Bcl-2, которые обычно создают поры в митохондриях. Поэтому их оболочки оставались целыми, и цитохром с не мог попасть в цитоплазму и вызвать апоптоз. Далее ученые исследовали причину, по которой в раковых клетках снизилось количество этих белков. Оказалось, что при гипоксии в клетках не работает белок-регулятор р53, который обеспечивает экспрессию (то есть считывание информации с гена и синтез белка) белков семейства Bcl-2. Для того чтобы вернуть опухоль на путь программируемой смерти, нужно искусственно — например, с помощью лекарств — активировать р53.
«Чтобы разработать эффективное лечение злокачественных новообразований, необходимо, прежде всего, изучить, каким способом можно преодолеть устойчивость раковых клеток к гибели. Для этого в дальнейших исследованиях мы планируем проверить, как действуют на опухоли вещества, активирующие белок р53 или же стимулирующие работу митохондрий при недостатке кислорода. Возможно, это станет основой для разработки новых препаратов против рака», — рассказывает Владимир Гогвадзе, доктор биологических наук, ведущий научный сотрудник лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ.
Информация и фото предоставлены пресс-службой МГУ