Ученые Института биологии ФИЦ Коми НЦ УрО РАН (г. Сыктывкар) ведут экспериментальные генетические исследования старения и долголетия. Рассматривая на модельных животных организмах механизмы продолжительности жизни в совокупности с рядом факторов, специалисты изучают причины, влияющие на скорость старения. Анализ результатов позволит выделить наиболее перспективные направления для будущих разработок по замедлению процессов старения человека
Понимание процесса старения человека и поиск возможных путей обретения долголетия – тема вечная и дискуссионная – до сих пор в центре внимания широкого круга специалистов. Развитие инноваций и высоких технологий изменили условия жизнедеятельности современных людей, а тем самым отодвинули границы проявлений биологического старения, способствуя сохранению сил и ресурсов, продлению полноценного функционирования физиологических систем и даже предоставлению возможности воспроизводить потомство в зрелом возрасте. Тем не менее, необратимый процесс старости и появление возраст-зависимых заболеваний заставляет ученых обращать внимание на комплекс разных причин, вызывающих изменение биологической составляющей организма человека. Изучение регенеративных процессов, экспрессии генов, методов фармакологической коррекции позволят понять причину и, вероятно, затормозить патологическое преобразование тканей, а значит увеличат число долгожителей.
Сотрудники Института биологии ФИЦ Коми НЦ УрО РАН (г. Сыктывкар) выясняют, какие факторы влияют на продолжительность жизни, возрастные изменения иммунитета, активную деятельность, противовирусную и антибактериальную реакцию организма. Экспериментальные исследования помогают изучить ключевые молекулярные механизмы антивозрастного действия, которые связаны с реакцией на стресс, антиоксидантной и противовоспалительной защитой клеток, в частности, понять, каков потенциал генов, отвечающих за регулирование продолжительности жизни у разных видов млекопитающих, и наблюдаемые закономерности.
Алексей Александрович Москалев – профессор, доктор биологических наук, член-корреспондент РАН, заведующий лабораторией геропротекторных и радиопротекторных технологий Института биологии ФИЦ Коми НЦ УрО РАН (г. Сыктывкар), главный научный сотрудник Научно-клинического геронтологического научного центра (г. Москва)
Алексей Александрович Москалев – профессор, доктор биологических наук, член-корреспондент РАН, заведующий лабораторией геропротекторных и радиопротекторных технологий Института биологии ФИЦ Коми НЦ УрО РАН (г. Сыктывкар), главный научный сотрудник Научно-клинического геронтологического научного центра (г. Москва) – рассказал о разных аспектах проводимых исследований и выявленных достижениях по вопросу продолжительности жизни.
«Генетику долголетия можно исследовать у людей-долгожителей (людей в возрасте более 90–100 лет). Это самый трудный путь по нескольким причинам. Во-первых, людей-долгожителей довольно мало, еще меньше тех, у кого индивидуально секвенировали геном (наследственную информацию хромосом) и транскриптом (совокупность матричных РНК, отражающих активность генов). Это существенно влияет на статистическую значимость выводов и вероятность ошибки. Кроме того, подобное научное исследование требует наличия контрольной выборки, которую не просто организовать в отношении долгожителей. Кто будет контролем? Люди из той же популяции и того же пола? Пожилые люди 80+? А если они тоже когда-то станут долгожителями (90+)? Второй генетический подход к старению – это модельные исследования с лабораторными животными, у которых с помощью генной инженерии активированы или выключены интересующие нас гены, что привело к существенному продлению жизни у таких линий животных в сравнении с родительскими линиями. Третий источник данных о долголетии – это долгоживущие млекопитающие как наиболее эволюционно близкие к человеку животные. Это эксперимент, который поставила сама природа. Например, слоны и серые киты живут в среднем столько же, как и большинство людей, а гренландские киты – примерно в два раза больше. Есть еще млекопитающие-экстремальные долгожители в сравнении с близкородственными видами. Например, голый землекоп живет в лаборатории более 30 лет, тогда как другие лабораторные грызуны – 3-4 года (мыши, крысы). Или мелкие летучие мыши, в частности ночница Брандта, которая является самым мелким долгоживущим млекопитающим, в дикой природе доживает до 40 и более лет при средней массе тела 8 г. Кстати с коллегой из Гарвардской медицинской школы Вадимом Гладышевым и сотрудниками Пекинского института генома мы в 2012 году впервые расшифровали ее геном и транскриптомы печени, почек и головного мозга. Правда, как прожить 30-40 лет, мы с вами и сами знаем.
Как вариант, есть еще более экстремальные долгожители, такие как гренландская акула (400+ лет), моллюск исландская циприна (500+), сосна долговечная (10000 лет). Можно сравнивать их геном с близкими «короткоживущими» видами. Интересно «подсмотреть» механизмы долголетия у таких видов и попытаться их применить у человека. Каким образом? Что касается долголетия, гены, влияющие на него, могут быть интересны как мишени для вмешательств. В общем-то любое лекарство – это активатор или ингибитор каких-либо белков или кодирующих их генов. Зная, какие гены нужно активировать/подавлять для долголетия, можно создать новые лекарства против возраст-зависимых заболеваний или для замедления самого старения у человека, –
Алексей Москалев подробно пояснил, какое значение имеют исследования по изучению молекулярных механизмов долголетия и зависимых от возраста изменений экспрессии генов. –
В настоящее время мы владеем методами, позволяющими прицельно активировать или выключать определенные гены у человека. Потому что далеко не все гены, в том числе связанные с долголетием, могут регулироваться с помощью лекарств. Генотерапевтические вмешательства сейчас успешно применяются для лечения редких наследственных заболеваний, а также для создания вакцин нового поколения от коронавируса. Можно ожидать создание вакцин долголетия, когда вместо «вредного» гена коронавирусного белка в клетки будут доставляться варианты генов, ассоциированные с долголетием.
Наконец, зная генетические отличия людей-долгожителей, или людей с высокими рисками возраст-зависимых заболеваний (болезни Альцгеймера, инсульта, инфаркта, сахарного диабета 2 типа, онкологии), в будущем можно рассмотреть преимущества и риски технологий редактирования генома, наподобие Crisp-Cas9. Если предварительно секвенировать и изучить геном пациента, технологии редактирования позволят «привести в соответствие» этот геном с геномами редко болеющих долгожителей. Кроме того, знание динамики активности генов с возрастом может способствовать разработке диагностических платформ для определения биологического возраста – созданию инструмента оценки соответствия здоровья человека его возрастной норме. Это позволит отслеживать эффективность фармакологических и других вмешательств в старение. Например, установить, позволяет ли какое-то лекарство снизить биологический возраст (скорость старения), если сравнить транскриптомный, протеомный или эпигеномный биологический возраст (все они так или иначе отражают активность генов) у пациента до и после терапии».
Специалисты Института биологии ФИЦ Коми НЦ УрО РАН ведут исследования разных аспектов продолжительности жизни. Так, ранее ученые рассмотрели антивозрастные свойства экстрактов черноплодной рябины и плодов морошки, поскольку качество и состав пищи несомненно оказывает влияние на состояние здоровья, а особенно некоторые растительные пигменты.
«В свое время нас заинтересовали потенциальные геропротекторные свойства веществ из группы терпенов (в частности каротиноиды) и полифенолов (например, антоцианы), в большом количестве содержащихся в различных ягодах. Про эти соединения было известно, что они снижают маркеры риска возраст-зависимых заболеваний у человека (артериальное давление, атеросклероз), повышают стрессоустойчивость клеток и соответствуют некоторым другим критериям геропротектора. Нам оставалось проверить их эффект на главный критерий – увеличение продолжительности жизни. Добавление в корм модельным животным экстрактов ягод аронии и морошки приводило к относительному увеличению продолжительности жизни, однако называть их ярко выраженными геропротекторами я бы не стал. По-видимому, они слабо влияют на фундаментальные механизмы старения и долголетия», – отметил Алексей Москалев.
Далее ученые изучили антиоксидантную активность фукоксантина (полученного из бурых водорослей) в клетках человека, предположив, что фукоксантин может иметь терапевтический потенциал для лечения возрастных заболеваний.
«Помимо экстрактов, мы изучаем и химически чистые вещества. Это более продуктивный путь, поскольку повышает воспроизводимость результатов и дает возможность более тщательного исследования зависимостей доза – эффект. Фукоксантин активирует ген фактора транскрипции NRF-2, который запускает целый каскад генов, обусловливающих собственную актиоксидантную и детоксифицирующую активность клеток организма. Нам удалось показать, что фукоксантин продлевает жизнь у двух модельных организмов – Drosophila melanogaster (муха дрозофила) и Caenorhabditis elegans (круглый червь), наверное, самых излюбленных животных в геронтологических исследованиях. Кроме того, он повышал стрессоустойчивость этих животных (то есть выживаемость при различных неблагоприятных воздействиях) и активацию генов, которые известны в связи с долголетием. Наконец, мы показали, что фукоксантин замедляет старение клеток человека в культуре», – уточнил ученый.
В большинстве исследований для идентификации ключевого молекулярного механизма возрастных изменений специалисты ФИЦ Коми НЦ УрО РАН использовали модель дрозофилы Drosophila melanogaster.
Алексей Москалев обосновал выбор ученых: «У каждой модельной системы есть свои достоинства и недостатки. Дрозофилы эволюционно довольно далеки от человека. Количество белок-кодирующих генов у них примерно в 2 раза меньше, чем у нас. Однако 75% генов, связанных с заболеваниями человека, имеют прямые функциональные гомологи (гены с общим эволюционным происхождением) у дрозофил. Благодаря именно этой модели были открыты хромосомная теория наследственности, мутагенез, гены эмбрионального развития животных и человека (гомеозисные гены, морфогены Notch, Wnt, “sonic hedgehog”), гены врожденного иммунитета против грибков, вирусов и бактерий (TLR), гены белков «теплового шока», поведения и старения человека. За эти исследования было получено несколько Нобелевских премий. Кстати, среди животных именно дрозофила была удостоена первого полностью секвенированного генома, что позволило разработать точные методы создания трансгенных животных, включать и выключать по желанию определенные гены в нужной ткани и стадии развития. Все известные нам группы генов долголетия (mTor, FOXO, IGF, AMPK, NRF-2, SIRT, PI3K) есть и у мухи, и у человека. Однако нас интересует поиск новых генов долголетия. Для модели дрозофил созданы методики включения-выключения интересующих генов, благодаря которым мы ищем долгоживущие линии, сравниваем их геномы и метаболомы с менее долгоживущими родительскими линиями».
Так, на модели дрозофилы было выявлено действие пептида Aβ на старение, продолжительность жизни и двигательную активность организма. По словам Алексея Москалева, «пептид Aβ, как предполагают, может накапливаться в тканях, образуя бляшки и способствуя возрастной нейродегенерации. Есть и другая точка зрения, что при старении человека нарушается барьер между кровотоком и тканью мозга, и в мозг начинают попадать инфекционные агенты – вирусы и бактерии, вызывающие воспалительные повреждения, а пептид Aβ – это антимикробный пептид, являющийся не причиной нейродегенерации, а скорее маркером ее. Дрозофилы слишком мало живут чтобы накапливать собственные амилоиды в тканях и страдать нейродегенерацией. Однако у них с возрастом ухудшается барьерная функция кишечника, в результате чего микробы массово проникают в организм, и животное умирает. Мы предположили, что, если пептид Aβ обладает антимикробной активностью, он защитит дрозофил от этого возрастного фактора смертности и увеличит продолжительность жизни, а возможно и иммунитет. Однако существенного продления жизни мы не наблюдали, как и усиления иммунитета».
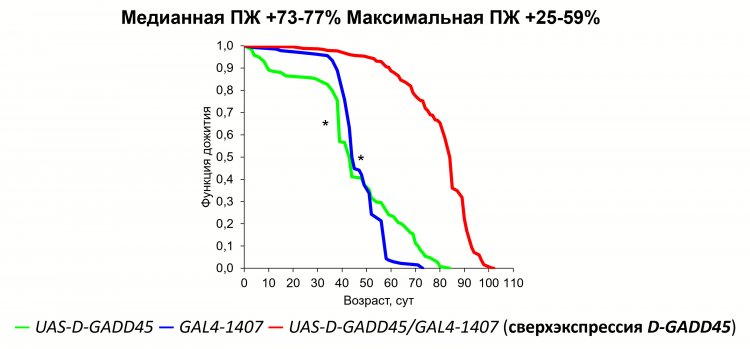
Рисунок 1. Влияние сверхэкспрессии гена D-GADD45 в нервной системе на продолжительность жизни дрозофил
Кроме того, были изучены эффекты генетического и фармакологического вмешательства в метаболизм H2S, который сопровождает процесс старения организма.
«Многие помнят, что низкокалорийное питание или периодическое голодание способно продлевать жизнь экспериментальным животным. Однако мало кто знает, что это связано с выработкой клетками, лишенными поступления с пищей аминокислоты метионина, сероводорода. Сероводород, наравне с другим газогормоном оксидом азота, в очень низких дозах играет сигнальную и защитную роль для клеток. Именно потому, что этот газ в микродозах так важен, в других концентрациях он уже сильный яд. Гормоны оказывают позитивные эффекты лишь в очень малых дозах. При старении снижается способность тканей образовывать микродозы сероводорода. Мы использовали генетические и фармакологические вмешательства для увеличения его выработки, что положительно сказалось на длительности жизни дрозофил», – сообщил исследователь.
Уникальные характеристики магнетита открывают широкий спектр его применения от диагностики до терапевтических средств. Так, было рассмотрено воздействие наночастиц Fe3O4 на экспрессию генов, отвечающих за продолжительность жизни дрозофилы.
По замечанию Алексея Москалева, «в химии наблюдается настоящий бум поисков применения наночастиц. Они могут быть потенциально полезными не только в технике, но и в медицине. Коллеги из Института химии ФИЦ Коми НЦ УрО РАН (г. Сыктывкар) занимаются прикладными разработками в области фуллеренов, наночастиц оксида железа и других наночастиц. Мы помогаем протестировать их безопасность. В частности, в нашей лаборатории было показано, что наночастицы Fe3O4 малотоксичные».
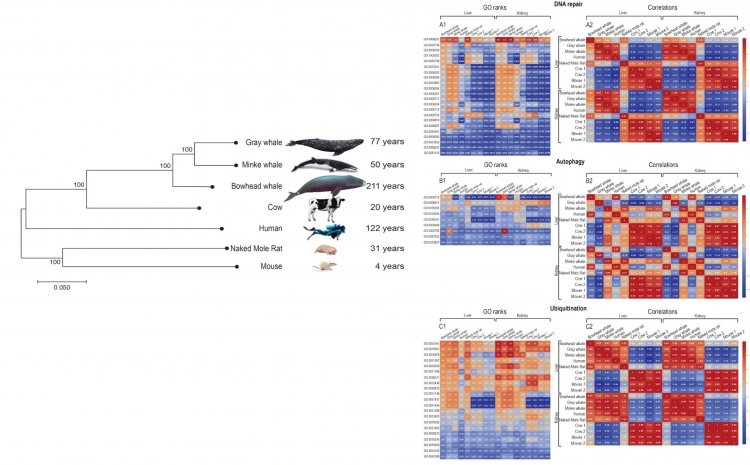
В 2019 году вместе с сотрудниками из Института молекулярной биологии имени Энгельгардта (г. Москва) и зарубежными коллегами из Румынии (Румынская академия, г. Бухарест,) и Израиля (Университет имени Бен-Гуриона в Негеве, г. Беэр-Шева) было проведено сравнение геномов и транскриптомов долгоживущих (китов) и короткоживущих видов млекопитающих. Учеными был разработан оригинальный метод для анализа экспрессии генов, основанный на ранжировании, который помог объяснить феномен долголетия китов, организмы которых наиболее адаптированы к стрессу и раку (об этом в статье «GRAY WHALE TRANSCRIPTOME REVEALS LONGEVITY ADAPTATIONS ASSOCIATED WITH DNA REPAIR AND UBIQUITINATION» //AGING CELL. 2020;19:e13158. //https://doi.org/10.1111/acel.13158).
«Насколько я знаю, это первая работа, в которой сравнивали уровни активности гомологичных генов разных видов млекопитающих. Самое сложное оказалось создать алгоритмы «нормирования» уровней активности генов (транскриптомов), без которого сравнение особей разных видов из разных исследований не представляется возможным. В результате удалось увидеть характерные для долгоживущих и короткоживущих видов млекопитающих «рисунки» активности групп генов, выполняющих разные функции. Наиболее значимо отличались гены китов, связанные с восстановлением ДНК, гены убиквитинирования, иммунитета и апоптоза. Дело в том, что в соматических клетках всего две копии каждой из хромосом (нитей ДНК). Поэтому поломка любой копии чревата серьезными последствиями для жизнеспособности клетки или создает риск ее опухолевой трансформации. Организм не станет долгожителем, если не способен быстро и эффективно чинить ДНК. Белки – основные структурные элементы клетки и молекулярные машины практически для всех процессов метаболизма. Если белки повреждаются (гликируются, окисляются), то они «сбиваются в кучу» (агрегируют) и мешают жизнедеятельности клетки. В клетке предусмотрены механизмы «растаскивания» и утилизации поврежденных и просто лишних белков, за которые отвечает убиквитинирование.
У китов уровни активности генов убиквитинирования были выше, чем у других сравниваемых млекопитающих. Если клетка «постарела», она начинает сообщать о своем неблагополучии другим клеткам в виде сигналов хронического воспаления, пытаясь тем самым вызвать на себя «огонь» иммунной системы, которая должна такие клетки удалять. Однако иммунный ответ снижается с возрастом, поэтому старые клетки накапливаются. Обычно поврежденные клетки уходят в апоптоз (альтруистический суицид), но сенесцентные клетки устойчивы к апоптозу. У китов же активность генов апоптоза выше. Активнее у них и гены иммунной системы. Коронавирус еще раз показал, что без крепкой иммунной системы вероятность прожить долго не велика», – информировал ученый.
Рисунок 2. Сравнение активности генов долго- и короткоживущих млекопитающих.
На текущий период главные предварительные итоги по исследованию старения и продолжительности жизни, по словам Алексея Москалева, следующие: «Наибольших успехов в продлении жизни в исследованиях на лабораторных животных нам удалось достичь при помощи генетических вмешательств – за счет включения или выключения определенных генов. Например, активация дополнительной копии гена ответа на повреждение ДНК (GADD45) в нервной ткани позволила продлить дрозофилам жизнь на 70%. Фармакологические воздействия пока что оказывают довольно слабый эффект. Наши с коллегами сравнительные исследования геномов и транскриптомов долгоживущих млекопитающих – ночницы Брандта, китов, позволили нащупать новые мишени для продления жизни, связанные с восстановлением ДНК».
Рисунок 3. Замены и делеции в генах рецепторов гормона роста и IGF1 ночницы Брандта.
«Мы также планируем продолжать поиски геропротекторных свойств веществ и растительных экстрактов. Тем не менее, все больше фактов говорит о том, что ключевые причины старения таятся вне клеток – в жесткости внеклеточного матрикса, чему мы и планируем посвятить несколько дальнейших экспериментальных работ. Кроме того, несколько наших исследований совместно с коллегами позволили создать модели биологического возраста человека – Artery Index и Aging.AI. Запущено два клинических исследования с использованием биологического возраста при воздействии биологически активных препаратов и плазмефереза», – нацелен Алексей Москалев.
Таким образом, исследованиями феномена старения на организменном, тканевом, клеточном, молекулярно-генетическом уровнях, продолжается активный научный поиск возможных подходов для замедления старения и достижения здорового долголетия.
Все фото и картинки предоставлены Алексеем Москалевым