Ученые обнаружили рациональный и эффективный механизм регенерации, при котором поврежденная мышца сама инициирует процесс регенерации, - пишет eurekalert.org.
При построении модели повреждения мышц в культивируемой системе ученые из Университета Кумамото и Университета Нагасаки в Японии обнаружили, что компоненты, вытекающие из сломанных мышечных волокон, активируют «спутниковые» мышечные стволовые клетки. Пытаясь идентифицировать белки, которые активируют сателлитные клетки, они обнаружили, что метаболические ферменты, такие как GAPDH, быстро активируют спящие сателлитные клетки и ускоряют регенерацию травм мышц. Это очень рациональный и эффективный механизм регенерации, при котором поврежденная мышца сама активирует сателлитные клетки, которые начинают процесс регенерации.
Скелетная мышца состоит из пучков сокращающихся мышечных волокон, и каждое мышечное волокно окружено клетками-сателлитами - мышечными стволовыми клетками, которые могут производить новые мышечные волокна. Благодаря работе этих сателлитных клеток мышечные волокна могут восстанавливаться даже после ушибов или разрывов во время интенсивных упражнений. Клетки-сателлиты также играют важную роль в росте мышц на стадиях развития и в гипертрофии мышц во время силовых тренировок. Однако при заболеваниях рефрактерных мышц, таких как мышечная дистрофия и возрастная хрупкость мышц (саркопения), количество и функция сателлитных клеток снижается. Поэтому важно понимать механизм регуляции сателлитных клеток в терапии регенерации мышц.
В зрелых скелетных мышцах сателлитные клетки обычно находятся в спящем состоянии. При стимуляции после мышечного повреждения сателлитные клетки быстро активируются и многократно размножаются. Во время последующего миогенеза они дифференцируются и регенерируют мышечные волокна путем слияния с существующими мышечными волокнами. Из этих трех стадий (активация сателлитных клеток, пролиферация и дифференцировка мышц) мало что известно о том, как индуцируется первая стадия - активация.
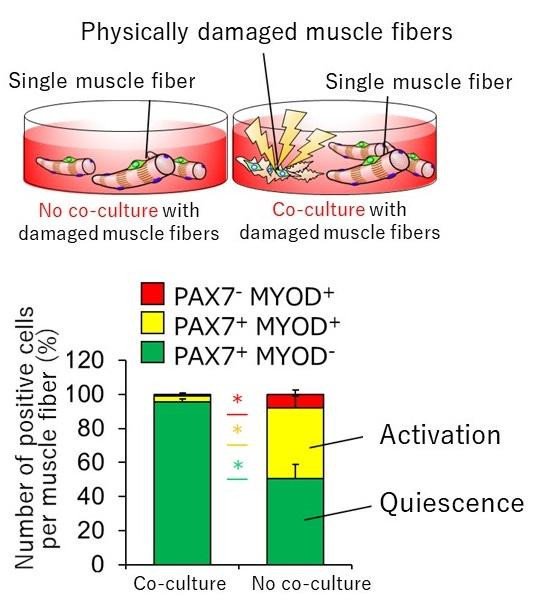
Поскольку сателлитные клетки активируются при повреждении мышечных волокон, исследователи предположили, что само повреждение мышц может вызвать активацию. Однако это трудно доказать на животных моделях мышечного повреждения, поэтому они построили модель клеточной культуры, в которой отдельные мышечные волокна, изолированные от мышечной ткани мыши, были физически повреждены и разрушены. Используя эту модель повреждения, они обнаружили, что компоненты, протекающие из поврежденных мышечных волокон, активируют сателлитные клетки, и активированные клетки входят в подготовительную фазу G1 клеточного деления. Кроме того, активированные клетки вернулись в спящее состояние, когда поврежденные компоненты были удалены, тем самым предполагая, что поврежденные компоненты действуют как переключатель активации.
Исследовательская группа назвала протекающие компоненты «факторами, производными от поврежденных миофибрилл» (DMDF) в честь сломанных мышечных волокон, и идентифицировала их с помощью масс-спектрометрии. Большинство идентифицированных белков были метаболическими ферментами, в том числе гликолитическими ферментами, такими как GAPDH, и ферментами отклонения мышц, которые используются в качестве биомаркеров мышечных расстройств и заболеваний. GAPDH известен как «подрабатывающий белок», который помимо своей первоначальной функции в гликолизе выполняет другие функции, такие как контроль гибели клеток и опосредование иммунного ответа. Поэтому исследователи проанализировали влияние DMDF, включая GAPDH, на активацию сателлитных клеток и подтвердили, что воздействие привело к их переходу в фазу G1. Кроме того, исследователи вводили GAPDH в скелетные мышцы мыши и наблюдали ускоренную пролиферацию сателлитных клеток после последующего повреждения мышц, вызванного лекарством. Эти результаты предполагают, что DMDF обладают способностью активировать спящие сателлитные клетки и вызывать быструю регенерацию мышц после травмы. Механизм, с помощью которого сломанная мышца активирует сателлитные клетки, является высокоэффективным и действенным механизмом регенерации тканей.
«В этом исследовании мы предложили новую модель травмирования и
регенерации мышц. Однако подробный молекулярный механизм того,
как DMDF активирует сателлитные клетки, остается неясной
проблемой для будущих исследований. Ожидается, что помимо
активации сателлитных клеток, функции подработки DMDF будут
разнообразными, - сказал доцент Юсукэ Оно, руководитель
исследования. - Недавние исследования показали, что скелетные
мышцы выделяют различные факторы, которые влияют на другие органы
и ткани, такие как мозг и жир, в кровоток, поэтому вполне
возможно, что DMDFs участвуют в связи между поврежденной мышцей и
другими органами через кровообращение. Мы считаем, что дальнейшее
выяснение функций DMDF может прояснить патологии некоторых
мышечных заболеваний и помочь в разработке новых лекарств».
[Фото: eurekalert.org]