Исследователи из ФИЦ «Институт цитологии и генетики СО РАН» изучают влияние длительного потребления этанола на поведение и центральную нервную систему мышей и то, как эти эффекты приема алкоголя зависят от особенностей генотипа у лабораторных животных. В будущем полученные знания можно будет применять для лечения людей.
Склонность к потреблению алкоголя — сложный поведенческий признак, в формирование которого вносят вклад и генетические факторы, и условия среды. К последним относятся абиотические (температура содержания, шум) и биотические (калорийность и состав корма) факторы, а также экспериментальные условия, например, стрессирующие воздействия.
Изучение эффектов средовых факторов может быть достаточно корректным только при условии использования в эксперименте животных определенных генотипов, так как на одно и то же средовое воздействие различные в генетическом отношении особи могут реагировать по-разному. Инбредные (полученные в результате скрещивания близкородственных форм в пределах одной популяции) линии лабораторных мышей позволяют более эффективно искать местоположения определенных генов (локусы) и изучать средовые факторы, способствующие развитию алкоголизма.
Ученые разных стран уже показали в своих работах, что при одинаковых условиях содержания инбредные линии значительно различаются по уровню предпочтения алкоголя: среди наиболее «пьющих» мышей можно выделить линию C57BL/6 и родственные ей (около 90 % предпочтения 10 %-го раствора этанола), а среди «малопьющих» лидерство занимает линия DBA/2 (3-5 % предпочтения 10 %-го раствора этанола). «Следовательно, генетические факторы играют важную роль в механизмах формирования алкогольного предпочтения. Но не стоит забывать, что в рамках одной линии животных на показатели потребления алкоголя оказывают влияние различные средовые воздействия. Уровень предпочтения этанола может меняться и в зависимости от продолжительности контакта с ним используемой дозы», — отмечает старший научный сотрудник лаборатории нейрогеномики поведения ФИЦ ИЦиГ СО РАН кандидат биологических наук Дарья Владимировна Базовкина.
Лабораторные грызуны — удобная модель для изучения влияния этанола на поведение и центральную нервную систему. У крыс и мышей чувствительность к острой алкогольной интоксикации можно определить, например, по интенсивности гипотермии (снижению температуры тела) или продолжительности сна после однократной инъекции этанола. «Как острое (разовое), так и хроническое введение этанола сказывается на двигательной активности, уровне тревожного и депрессивноподобного поведения. Со стороны ЦНС это, конечно же, нарушение процессов взаимодействия возбуждения и торможения, обусловленное изменениями в работе медиаторов головного мозга, таких как ГАМК (гамма-аминомасляная кислота, участвующая в цикле сна и отвечающая за гашение возбуждающих сигналов), дофамин, норадреналин, серотонин. При этом эффекты алкоголя в значительной степени контролируются на уровне ключевых элементов нейромедиаторных систем: транспортеров, ферментов метаболизма и рецепторов. Нас привлекает изучение участия серотониновой системы мозга в механизмах действия этанола, поскольку, с одной стороны, серотонин регулирует проявление многих видов поведения как в норме, так и при патологии. А с другой стороны, уже не вызывает сомнения, что дисфункции серотониновой нейромедиаторной системы могут стать причиной развития алкоголизма», — рассказывает Дарья Базовкина.
Для оценки изменений в поведении грызунов ученые применяют тесты. Уровень тревожности, как правило, исследуют в тестах «открытое поле», «темно-светлая камера», «приподнятый крестообразный лабиринт» (https://youtu.be/RDolS5kjvzM). В основе этих тестов лежит конфликт между желанием животного остаться в безопасном месте (преобладание тревожного типа поведения) или исследовать новое открытое или ярко освещенное (то есть потенциально опасное) пространство. Уровень депрессивноподобного поведения определяют в тестах «принудительное плавание» (Forced swimming test), «подвешивание за хвост» (Tail suspension test) и тесте на потребление сахарозы. В первых двух тестах фиксируется продолжительность замирания, которое исследователи ассоциируют с так называемым поведением отчаяния. Известно, что классические антидепрессанты снижают этот параметр поведения. Что касается потребления сахарозы у грызунов, то оно снижается при усилении депрессивноподобного поведения, что рассматривается как аналог ангедонии (отказ от удовольствий) при депрессивных расстройствах. Когнитивные способности и память исследуются в таких тестах, как, например, «водный лабиринт Морриса» и «распознавание нового объекта». В первом тесте животное ищет спрятанную под водой платформу на основании предыдущей памяти о ее местонахождении. Во втором тесте оценивается уровень предпочтения нового для животного объекта по сравнению с уже знакомым объектом.
Пристрастие к алкоголю проверяют следующим образом: животным в течение нескольких дней или недель предоставляют для питья одновременно этанол определенной концентрации и воду. Поилки с водой и спиртом меняют местами, так как, по некоторым данным, у лабораторных грызунов может вырабатываться условный рефлекс на положение сосуда с предпочитаемой жидкостью. Предпочтение этанола, как правило, оценивают по доле выпитого этанола от общего объема потребленной жидкости (в процентах). Конечно же, для характеристики уровня предпочтения этанола у инбредных линий следует использовать так называемых интактных животных, то есть тех, которые раньше не были знакомы с алкоголем.
Нейромедиатор серотонин — один из наиболее важных медиаторов мозга, он участвует в регуляции многочисленных функций ЦНС, таких как способность поддержания температуры тела, секреция гормонов, реакция на стресс, аппетит и жажду. А еще серотонин контролирует выраженность многих форм и нормального поведения, и расстройств психики (депрессии, тревожности, шизофрении, алкоголизма). Селективные ингибиторы обратного захвата серотонина в настоящее время являются препаратами первой линии, которые используются в качестве антидепрессантов.
Постепенно накапливается всё больше данных об участии 5-НТ-рецепторов серотониновой системы мозга в механизмах аффективных расстройств и алкогольной зависимости. Одним из ключевых рецепторов является 5-НТ1А-рецептор, поскольку он не только вовлечен в развитие таких нарушений психики, как депрессия, тревожность, но и регулирует функциональную активность серотониновой нейромедиаторной системы по механизму обратной связи.
«Длительное потребление алкоголя может привести к повышенной экспрессии гена 5-НТ1А-рецептора в области среднего мозга и, как следствие, снижению концентрации серотонина в синаптической щели (пространстве между нейронами, где происходит обмен нейромедиаторами) и развитию тревожного и депрессивного поведения», — отмечает Дарья Владимировна. Также ученые подтвердили участие других серотониновых рецепторов в эффектах алкоголя. К примеру, блокада 5-НТ3-рецепторов в мозге уменьшает у грызунов потребление этанола и снижает выраженность его действия на ЦНС. А стимуляция 5-НТ2А-рецепторов не только приводит к уменьшению предпочтения алкоголя, но и меняет выраженность депрессивноподобного поведения, обусловленного введением этанола.
Еще одним важным элементом серотониновой нейромедиаторной системы является триптофангидроксилаза-2. Это ключевой фермент синтеза серотонина в мозге. У лабораторных мышей был обнаружен в гене триптофангидроксилазы-2 функциональный полиморфизм С1473G, включающий замену нуклеотидов, которая приводит к двукратному снижению активности этого фермента в мозге.
Линии мышей можно разделить на две группы по активности триптофангидроксилазы-2: группу с низкой активностью фермента (мыши, гомозиготные по 1473G-аллелю, например, линия CC57BR) и группу с высокой активностью фермента (мыши, гомозиготные по 1473С-аллелю, например, линия С57Bl/6). Примечательно, что в дикой природе мыши с 1473G-аллелем не живут.
В лаборатории нейрогеномики ФИЦ ИЦиГ СО РАН были получены две конгенные линии мышей B6-1473C и B6-1473G, отличающиеся разными аллелями гена триптофангидроксилазы-2 и, соответственно, активностью фермента синтеза серотонина. Исследователи показали, что эти линии различаются по выраженности межсамцовой агрессии, депрессивноподобного поведения и устойчивости к действию некоторых антидепрессантов. Кроме этого, острое введение этанола по-разному влияло на уровень тревожного поведения у мышей этих линий. «Таким образом, эти результаты являются еще одним неоспоримым доказательством важной роли фермента триптофангидроксилазы-2 в регуляции поведенческих реакций и их центральных механизмов», — подчеркивает Дарья Владимировна.
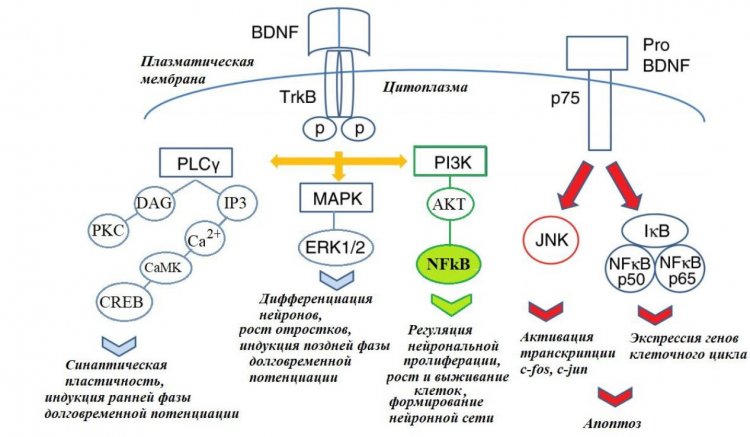
Также для развития и нейропластичности мозга очень важен нейротрофический фактор BDNF (Вrain-derived neurotrophic factor), который тесно взаимодействует с серотониновой нейромедиаторной системой. Следует пояснить, что для ЦНС имеют большое значение оба: и зрелый BDNF, и его белок-предшественник proBDNF, однако эти белки различаются функционально. BDNF связывается преимущественно с тропомиозиновым тирозинкиназным В-рецептором (TrkB), и в результате запускаются положительные для нервной системы процессы, такие как рост и выживаемость нейронов. В то же время предшественник proBDNF обладает противоположными функциями: он связывается с р75-рецептором, что может инициировать апоптоз (гибель клеток) в мозге. В последние годы активно изучается участие сложного комплекса, включающего BDNF, proBDNF и их рецепторы, в механизмах развития алкогольной зависимости. Например, есть данные о том, что мыши с генетически обусловленным сниженным содержанием BDNF в мозге проявляют повышенное влечение к этанолу.
Также на животных было показано, что при длительном потреблении этанола содержание BDNF и его рецептора TrkB в гиппокампе снижается, а рецептора p75, опосредующего действие proBDNF, напротив, повышается. Это означает, что алкоголизация приводит к активации апоптотических процессов и нейродегенерации, которые сопровождаются негативными изменениями в поведении. В лаборатории нейрогеномики поведения ФИЦ ИЦиГ СО РАН особенное внимание придается изучению роли взаимодействия BDNF и серотониновой системы мозга в регуляции эффектов алкоголя. Так, было показано, что у мышей инбредной линии C57BL/6 длительное потребление этанола привело к росту активности триптофангидроксилазы-2 и повышению уровней белков proBDNF и р75 в среднем мозге, — структуре, где, собственно, происходит основной синтез серотонина. Примечательно и то, что мыши линии B6-1473G (с пониженной активностью триптофангидроксилазы-2) оказались более чувствительны к длительному действию этанола на уровне экспрессии генов, отвечающих за нейропластичность и выживаемость нейронов, по сравнению с мышами линии B6-1473C (с нормальной активностью фермента синтеза серотонина). Эти факты красноречиво свидетельствуют об участии взаимодействия серотониновой системы мозга и BDNF в механизмах действия этанола.
Ученые из ФИЦ ИЦиГ СО РАН показали у мышей «депрессивной» и «недепрессивной» линий различное влияние хронической алкоголизации на паттерны экспрессии белков BDNF и его предшественника proBDNF в префронтальной коре и гиппокампе, структурах мозга, которые вовлечены в развитие аффективных расстройств. У животных с генетической предрасположенностью к депрессивноподобному поведению хроническая алкоголизация приводит к повышению уровня белка proBDNF в коре, в то время как у «недепрессивных» мышей длительная алкоголизация приводит к снижению уровня BDNF в гиппокампе. Исходя из того, что известно о функциях зрелого BDNF и его белка-предшественника, можно предположить, что длительная алкоголизация запускает апоптотические и нейродегенеративные процессы в мозге у мышей с предрасположенностью к депрессивноподобному поведению и снижает интенсивность важного для нейропластичности фактора — BDNF-зависимого нейрогенеза у «недепрессивных» животных.
Мария Фёдорова
Схема из открытых источников, фото Александры Федосеевой
Информация и фото предоставлены Управлением по пропаганде и популяризации научных достижений СО РАН