Исследователи во главе с биологами из Университета Тафтса обнаружили, что мозг развивающихся эмбрионов посылает сигналы формирующейся иммунной системе, которые помогают ей отразить инфекции и значительно улучшают способность эмбриона выживать, - пишет eurekalert.org со ссылкой на NPJ Regenerative Medicine.
Используя эмбрионы лягушки, которые продолжают развиваться после удаления мозга, исследователи обнаружили, что эмбрионы без мозга не способны распределять силы иммунных клеток в месте повреждения или инфекции, что приводит к более быстрому заражению эмбриона инфекцией. Напротив, наличие мозга решающим образом направляет иммунные клетки к месту повреждения, чтобы преодолеть бактериальную угрозу.
У развивающегося эмбриона мозг и иммунная система сформированы не полностью. Иммунная система состоит в основном из «врожденной» системы клеток, которые немедленно реагируют на инфекцию и не требуют обучения или выработки антител. Однако эти клетки требуют сигналов, которые побуждают их двигаться к месту заражения и инициировать ответ.
Исследовательская группа обнаружила, что мозг, по-видимому, вносит вклад в сигналы, которые направляют формирующуюся иммунную систему. Когда эмбрионы лягушек, не имеющих мозга, были заражены кишечной палочкой, выжило только около 16% эмбрионов, а наличие мозга защищало более 50% эмбрионов от инфекции. Следуя маркерам иммунных клеток, исследователи подтвердили, что эффект достигался тем, что мозг посылал иммунным клеткам сигналы о направлении инфекции.
«Мы обнаружили, что макрофаги - врожденные клетки иммунной системы, которые могут поглощать бактерии и уничтожать их, чтобы уменьшить бремя инфекции, не мигрируют должным образом без присутствия мозга, - сказал Майкл Левин - профессор биологии в Университете Тафтса и автор исследования. - Без мозга и его нейротрансмиттерных сигналов экспрессия генов и активность врожденной иммунной системы нарушаются, что приводит к повышенной восприимчивости к бактериальным патогенам».
Другие роли для передачи сигналов эмбрионального мозга во время инфекции могут включать в себя индукцию клеточных реакций, например, предотвращение гибели клеток или уменьшение воспаления, которые помогают защитить от вредного воздействия инфекции.
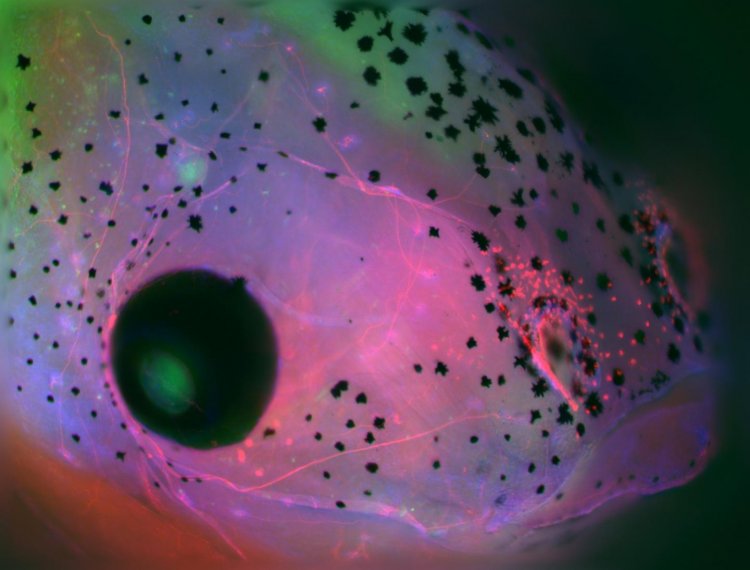
Аберрации иммунной системы также наблюдались у эмбрионов без мозга, которые получили дальнейшее развитие. Когда исследователи отследили миелоидные клетки - класс иммунных клеток, который включает макрофаги, нейтрофилы и другие, после травмы, они обнаружили, что миелоидные клетки в эмбрионах без головного мозга собрались в местах, удаленных от места повреждения. Напротив, миелоидные клетки в нормальных эмбрионах с неповрежденным мозгом будут накапливаться в месте повреждения, чтобы способствовать заживлению. На самом деле у эмбрионов без головного мозга миелоидные клетки имели тенденцию группироваться вокруг аномальных, дезорганизованных периферических нервных сетей, также являющихся побочным продуктом отсутствия мозга, как было продемонстрировано в более ранних исследованиях.
Изучение аберраций в генетической экспрессии у эмбрионов без головного мозга также указало на уменьшение нейротрансмиттера дофамина (сигнального химического вещества, используемого в мозге для обучения и мотивации). При этом стало понятно, что дофамин может играть роль в активации иммунных клеток для миграции на ранних стадиях инфекции. Отсутствие скопления иммунных клеток в месте заражения делает для эмбрионов без мозга летальный исход более вероятным.
«Наши результаты демонстрируют глубокие взаимосвязи между осью
бактерия-мозг-тело: ранний мозг способен «чувствовать» патогенные
бактерии и разрабатывать ответные меры, направленные на борьбу с
клеточными и молекулярными последствиями инфекции», - сказала
Селия Эррера Ринкон - научный сотрудник Центра открытий Аллена в
Тафтсе и первый автор исследования.
[Фото: eurekalert.org]