Максим Абакумов, кхн, заведующий лабораторией «Биомедицинские наноматериалы» НИТУ «МИСиС», доцент кафедры медицинских наноматериалов МБФ ФГБОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России
Научная команда НИТУ «МИСиС» и РТУ «МИРЭА» внедрила новый диагностический инструмент для отслеживания доставки гидрофобных бактериохлоринов к опухолевой ткани с помощью МРТ.
Методы тераностики дают возможность оценить заболевание на клеточном уровне, обнаружить раковые клетки и спрогнозировать эффективность доставки лекарственного средства нового класса. Нанотехнологии способствуют усовершенствованию методов диагностики заболеваний. Поэтому объединение диагностических и терапевтических методов предусматривает использование наночастиц для адресной доставки лекарств или поиска в организме раковых и других неблагополучных клеток с целью их ликвидации.
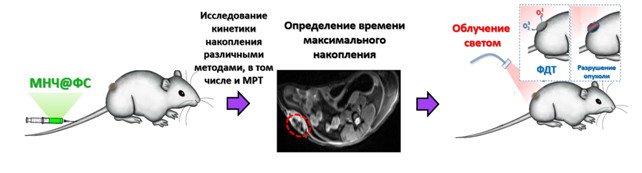
Российские учёные провели работу, в которой отследили, как магнитные наночастицы, нагруженные молекулами, были интернализованы в раковые клетки, и это вызвало фотоиндуцированную гибель клеток. Динамика накопления препарата отслеживалась с помощью магнитно-резонансной томографии (МРТ).
В чем заключается метод фотодинамической терапии для лечения рака и каковы результаты испытаний нового подхода терапевтического комплекса, выявленные коллективом московских учёных, – рассказал один из участников исследования - Максим Абакумов - кандидат химических наук, заведующий лабораторией «Биомедицинские наноматериалы» НИТУ «МИСиС», доцент кафедры медицинских наноматериалов МБФ ФГБОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России. Полученные данные обнародованы в международном научном журнале Journal of Colloid and Interface Science (вып. 537(2019)-132-141).
«Фотодинамическая терапия (ФДТ) - это относительно новый метод лечения рака. Он основан на использовании специальных органических молекул – фотосенсибилизаторов (ФС). Эти молекулы способны под действием света определенной длины волны производить активные формы кислорода (АФК) – свободные радикалы, которые являются высокотоксичными для клеток. При этом в отсутствии света ФС практически нетоксичны, - пояснил Максим Абакумов и добавил - К сожалению, большая часть используемых молекул плохо растворима в воде, кроме того, из-за ограничения по прозрачности наших тканей для света их использование для терапии глубоких тканей ограничено».
Для этого исследования в качестве фотосенсибилизатора были взяты гидрофобные бактериохлорины, которые обладают рядом определенных преимуществ. «Во-первых, они поглощают и испускают свет в инфракрасном диапазоне, в котором наше тело наиболее прозрачно. Это позволяет добиться максимальной глубины терапии. Во-вторых, их легко химически модифицировать для эффективной загрузки в наночастицы. В-третьих, они показывают очень высокую эффективность в фотодинамической терапии, но их гидрофобность ограничивает их применение. Солюбилизация (то есть процесс перевода в растворимую форму) с помощью наночастиц помогает обойти этот недостаток. Фотосенсибилизатор сам по себе в воде не растворяется, однако при включении в состав наночастиц он заключается в оболочку из альбумина, что позволяет получить стабильный коллоидный раствор, пригодный для инфузии», - объяснил Максим Абакумов.
Нанодиагностика проходила в лабораторных условиях (in vitro) и в естественных условиях на мышах (in vivo). «На клеточных культурах мы проверяли, повлияла ли загрузка ФС в наночастицы на его способность проникать в клетки и убивать их под действием света. В экспериментах на животных мы показали, что после введения в кровоток ФС и наночастицы остаются прочно связанными, их можно использовать как для МРТ-диагностики, так и для ФДТ, - сообщил Абакумов и подчеркнул - Мы соблюдали все международные биоэтические нормы, а работы были одобрены локальными этическими комитетами».
Наблюдение за процессом доставки лекарств к месту опухоли имеет важное значение для сокращения времени облучения. В данном случае наночастицы продемонстрировали долговременную стабильность и эффективность в доставке молекул бактериохлоринов в раковые клетки. На живых организмах был проверен механизм доставки лекарств в злокачественные новообразования с помощью магнитно-резонансной томографии (МРТ), широко используемой для диагностики in vivo. Оба метода показали накопление наночастиц и молекул в одной и той же опухоли, а выявленная разница между ними позволила отслеживать динамику накопления молекул с помощью МРТ.
Почему же качестве стратегии лечения рака выбрана именно фотодинамическая терапия? Фотодинамическая терапия имеет свою специфику и ограничения. Важно контролировать уровень фотосенсибилизаторов в тканях организма и время облучения источником света. По словам российского химика, «идея проекта и заключалась в том, чтобы предложить подход к усовершенствованию существующего метода». Максим Абакумов отметил далее: «Разработанная нами система позволяет проводить мониторинг доставки фотосенсибилизаторов методом МРТ, который не ограничен ни глубиной залегания опухоли, ни ее положением. Уже после того, как по данным МРТ обнаружено, что опухоль успешно накопила фотосенсибилизаторы, можно приступать к непосредственной терапии».
Замысел этого исследования воплотился благодаря многолетнему сотрудничеству с группой коллег из Московского технологического университета МИТХТ. Руководил проектом заведующий кафедрой химии и технологии биологически активных соединений, медицинской и органической химии ФГБОУ ВО МИРЭА Российского технологического университета, доктор химических наук, профессор Михаил Грин.
Работа, которая заняла примерно 3 года, проводилась большим коллективом учёных. В экспериментах принимали участие химики из Московского технологического университета (МИТХТ), Национального исследовательского технологического университета «МИСиС» и Российского национального исследовательского медицинского университета имени Н.И. Пирогова (РНИМУ им. Н.И.Пирогова), а биологические исследования проводились на базе РНИМУ им. Н.И.Пирогова.
В чём состоит инновационный подход терапевтической системы для борьбы с онкологическими заболеваниями, предложенный участниками в рамках данного проекта? По убеждению Абакумова, «основная оригинальность подхода кроется в деталях. При проведении ФДТ важно совместить по временной шкале два события: период максимального накопления ФС в опухоли и собственно время ФДТ. Для перехода к персонифицированной терапии необходимо учитывать гетерогенность опухолей (то есть различия между клетками одной и той же опухоли) у каждого пациента, и по идее, сначала необходимо с помощью оптических методов определить, когда накопление ФС максимально (ФС флуоресцируют) и после этого давать «отмашку» врачу на начало ФДТ».
В современной тераностике возможности продвижения этого метода в неоднозачны. По мнению российского исследователя, «здесь есть две проблемы: во-первых, и флуоресценция (испускание света определенной длины волны при облучении светом с более короткой длиной волны), и продукция АФК (производство активных форм кислорода под действием светового излучения) - это энергозависимые процессы. При этом оба они вызываются одним источником - светом. То есть чем сильнее ФС (фотосенсибилизатор) работает как лекарство, тем хуже он флуоресцирует. Во-вторых, если мы говорим про рак кожи, то здесь эта схема проста и осуществима: а) ввели ФС; б) подвели источник света и детектор к опухоли; в) определили, когда накопление ФС достигло максимума (а это десятки минут или, даже, часы); г) провели ФДТ (фотодинамическую терапию). Однако данный метод неприемлем для терапии заболеваний внутренних органов, например, рака желудка, кишечника или лёгких».
Максим Абакумов считает: «Наш подход позволяет неинвазивно отслеживать накопление препарата по МРТ и только в момент самой ФДТ прибегать к инвазивным процедурам».