Нобелевская премия по физиологии и медицине 2023 г. присуждена Каталин Карико (Katalin Karikó) и Дрю Вайсману (Drew Weissman) «за открытия в области модификации нуклеозидных оснований, позволившие создать эффективные мРНК-вакцины против COVID-19».
Открытия двух нобелевских лауреатов сыграли решающее значение в разработке эффективных мРНК-вакцин против COVID-19 во время пандемии, которая началась в начале 2020 г. Благодаря своим революционным открытиям, которые коренным образом изменили понимание того, как мРНК взаимодействует с иммунной системой, лауреаты внесли вклад в в беспрецедентно быстрые темпы разработки вакцины во время одной из самых больших угроз здоровью человечества в наше время.
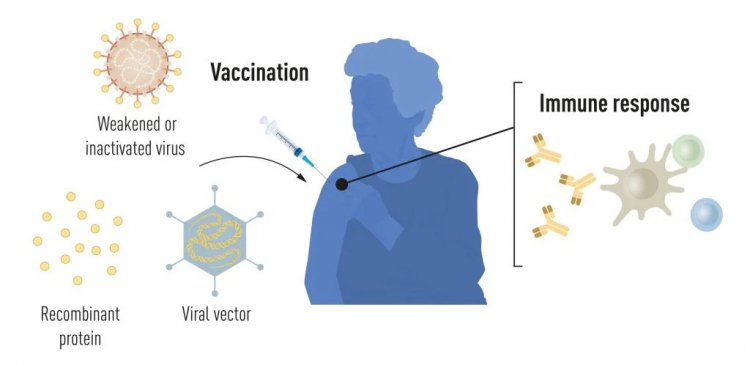
Вакцины до пандемии
Вакцинация стимулирует формирование иммунного ответа на определенный возбудитель. Это дает организму преимущество в борьбе с болезнью в случае последующего заражения. Вакцины, основанные на убитых или ослабленных вирусах, существуют уже давно, примером тому служат вакцины против полиомиелита, кори и желтой лихорадки. В 1951 г. Макс Тейлер был удостоен Нобелевской премии по физиологии и медицине за разработку вакцины против желтой лихорадки.
Благодаря прогрессу в молекулярной биологии в последние десятилетия были разработаны вакцины, основанные не на целых вирусах, а на отдельных вирусных компонентах. Части вирусного генетического кода, обычно кодирующие белки, находящиеся на поверхности вируса, используются для создания белков, стимулирующих образование антител, блокирующих вирус. В качестве примера можно привести вакцины против вируса гепатита В и вируса папилломы человека. Кроме того, часть вирусного генетического кода может быть перенесена в безвредный вирус — «вектор». Этот метод используется в вакцинах против вируса Эбола. При введении векторных вакцин выбранный вирусный белок вырабатывается в наших клетках, стимулируя иммунный ответ.
Производство цельновирусных, белковых и векторных вакцин требует использования крупномасштабных культур клеток. Этот ресурсоемкий процесс ограничивает возможности быстрого производства вакцин в ответ на вспышки и пандемии. Поэтому исследователи давно пытались разработать вакцинные технологии, не зависящие от культуры клеток, но это оказалось непростой задачей.
Рисунок 1. Методы производства вакцин до пандемии COVID-19.
Источник: Mattias Karlén / Нобелевский комитет по физиологии и медицине
МРНК-вакцины: Перспективная идея
В наших клетках генетическая информация, закодированная в ДНК, переносится на информационную РНК (мРНК), которая используется в качестве шаблона для производства белков. В 1980-х гг. появились эффективные методы получения мРНК без клеточной культуры, получившие название транскрипции in vitro. Идеи использования мРНК-технологий в вакцинальных и терапевтических целях также получили развитие, однако на этом пути возникли препятствия. Транскрибированная in vitro мРНК считалась нестабильной и сложной для доставки, что требовало разработки сложных липидных систем-носителей для инкапсуляции мРНК. Кроме того, мРНК, полученная in vitro, вызывала воспалительные реакции.
Эти препятствия не остановили венгерского биохимика Каталин Карико, которая посвятила себя разработке методов использования мРНК в терапии. В начале 1990-х гг., будучи доцентом Пенсильванского университета, она оставалась верна своей идее реализации мРНК в качестве терапевтического средства, несмотря на все трудности. Новым коллегой Карико в ее университете стал иммунолог Дрю Вайсман. Его интересовали дендритные клетки, выполняющие важные функции в иммунном надзоре и активации вакциноиндуцированных иммунных реакций. Подстегнутые новыми идеями, они вскоре начали плодотворное сотрудничество, сосредоточившись на изучении взаимодействия различных типов РНК с иммунной системой.
Прорыв
Карико и Вайсман заметили, что дендритные клетки распознают транскрибированную in vitro мРНК как чужеродное вещество, что приводит к их активации и высвобождению воспалительных сигнальных молекул. Их интересовало, почему транскрибированная in vitro мРНК распознается как чужеродная, в то время как мРНК из клеток млекопитающих не вызывает такой реакции. Карико и Вайсман поняли, что какие-то важные свойства должны отличать различные типы мРНК.
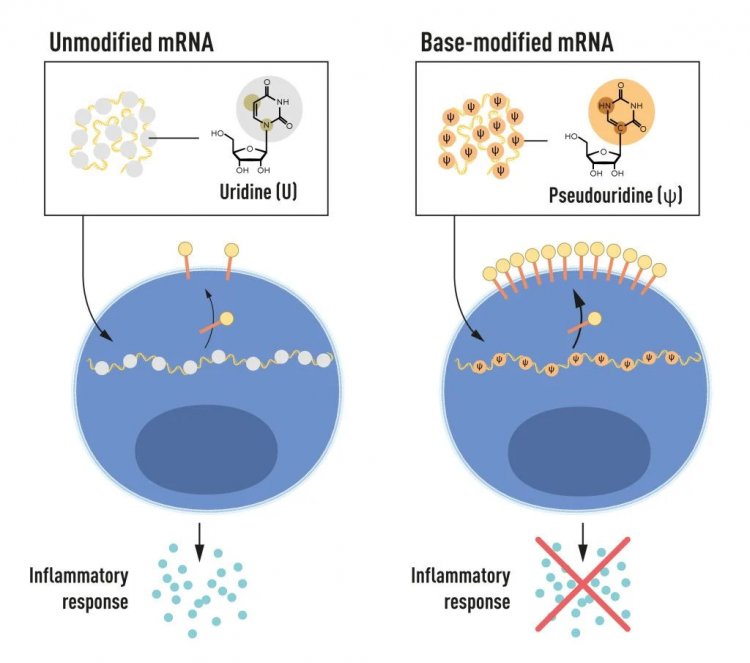
РНК содержит четыре основания, сокращенно A, U, G, и C соответствующие A, T, G, и C в ДНК — буквам генетического кода. Карико и Вайсман знали, что основания в РНК из клеток млекопитающих часто подвергаются химической модификации, а в транскрибируемой in vitro мРНК — нет. Они задались вопросом, может ли отсутствие измененных оснований в транскрибируемой in vitro РНК объяснять нежелательную воспалительную реакцию. Для этого были получены различные варианты мРНК с уникальными химическими изменениями в основаниях, которые были доставлены в дендритные клетки. Результаты оказались поразительными: Воспалительная реакция практически исчезала, если в мРНК включались модификации оснований. Это стало изменением парадигмы в понимании того, как клетки распознают и реагируют на различные формы мРНК. Карико и Вайсман сразу же поняли, что их открытие имеет огромное значение для использования мРНК в терапии. Эти основополагающие результаты были опубликованы в 2005 г., за пятнадцать лет до пандемии COVID-19.
Рисунок 2. мРНК содержит четыре различных основания, сокращенно A, U, G и C. Нобелевские лауреаты обнаружили, что модифицированные основания мРНК могут быть использованы для блокирования активации воспалительных реакций (секреции сигнальных молекул) и увеличения производства белка при доставке мРНК в клетки.
Источник: Mattias Karlén / Нобелевский комитет по физиологии и медицине
В дальнейших исследованиях, опубликованных в 2008 и 2010 гг., Карико и Вайсман показали, что доставка мРНК, созданной с модификацией оснований, заметно увеличивает продукцию белка по сравнению с немодифицированной мРНК. Этот эффект был обусловлен снижением активации фермента, регулирующего выработку белка. Открыв, что модификации оснований одновременно снижают воспалительную реакцию и увеличивают выработку белка, Карико и Вайсман устранили критические препятствия на пути к клиническому применению мРНК.
мРНК-вакцины реализовали свой потенциал
Интерес к мРНК-технологии начал расти, и в 2010 г. несколько компаний работали над созданием этого метода. Были разработаны вакцины против вируса Зика и MERS-CoV, который является близким родственником SARS-CoV-2. После вспышки пандемии COVID-19 рекордными темпами были созданы две базовые модифицированные мРНК-вакцины, кодирующие поверхностный белок SARS-CoV-2. Защитный эффект составил около 95%, и обе вакцины были одобрены уже в декабре 2020 г.
Впечатляющая гибкость и скорость создания мРНК-вакцин открывают путь к появлению вакцин против других инфекционных заболеваний. В будущем эта технология может быть использована для доставки терапевтических белков и лечения некоторых видов рака.
Также быстро были внедрены несколько других вакцин против SARS-CoV-2, созданных по различным методикам, и в общей сложности в мире было введено более 13 млрд. доз вакцины COVID-19. Эти вакцины спасли миллионы жизней и предотвратили тяжелые заболевания у многих других людей, позволив обществу вернуться к нормальной жизни. Благодаря своим фундаментальным открытиям важности модификации оснований в мРНК, нобелевские лауреаты этого года внесли огромный вклад в решение одного из крупнейших кризисов здравоохранения нашего времени.
Объявление о присуждении Нобелевской премии по физиологии и медицине за 2023 г.
Источник: Press release. NobelPrize.org. Nobel Prize Outreach AB 2023. Mon. 2 Oct 2023.
Ключевые публикации
Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA.Immunity 23, 165–175 (2005).
Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
Каталин Карико (Katalin Karikó) родилась в 1955 г. в г. Сольнок (Венгрия). В 1982 г. она получила степень доктора философии в Сегедском университете и до 1985 г. проводила постдокторские исследования в Венгерской академии наук в Сегеде. Затем она проводила постдокторские исследования в Темплском университете (Филадельфия) и Университете медицинских наук (Бетесда). В 1989 г. она была назначена доцентом Пенсильванского университета, где оставалась до 2013 г. После стала вице-президентом, а затем старшим вице-президентом компании BioNTech RNA Pharmaceuticals. С 2021 г. является профессором Сегедского университета и адъюнкт-профессором Медицинской школы Перельмана при Пенсильванском университете.
Дрю Вайсман (Drew Weissman) родился в 1959 г. в Лексингтоне (Массачусетс, США). В 1987 г. получил степени доктора медицины и доктора философии в Бостонском университете. Прошел клиническую стажировку в медицинском центре Beth Israel Deaconess Medical Center при Гарвардской медицинской школе и постдокторские исследования в Национальном институте здоровья. В 1997 г. Вайсман основал свою исследовательскую группу в Медицинской школе Перельмана Пенсильванского университета. Сегодня он является директором Пенсильванского института инноваций в области РНК.
Источники
The Nobel Prize. Press release. NobelPrize.org. Nobel Prize Outreach AB 2023. Mon. 2 Oct 2023.
Фото на странице: Niklas Elmehed / Nobel Prize Outreach, Mattias Karlén / Нобелевский комитет по физиологии и медицине.