Когда нейрон в нашем теле повреждается, сегменты РНК производят белки, которые помогают восстановить повреждение. Но при неврологических заболеваниях, таких как боковой амиотрофический склероз и спинальная мышечная атрофия, или после травм спинного мозга механизмы перемещения жизненно важной РНК к поврежденным участкам клетки дают сбой. В результате молекулы РНК не могут попасть туда, где они нужны, и повреждения становятся необратимыми.
Исследователи из Стэнфорда разработали технологию транспортировки РНК к определенным местам внутри нейрона, где она может восстанавливать и даже выращивать заново части клетки. Работа закладывает основу для нового класса терапевтических средств, который исследователи называют «пространственной РНК-медициной». Ученые надеются, что препараты приведут к лечению неврологических заболеваний, а также травматических повреждений.
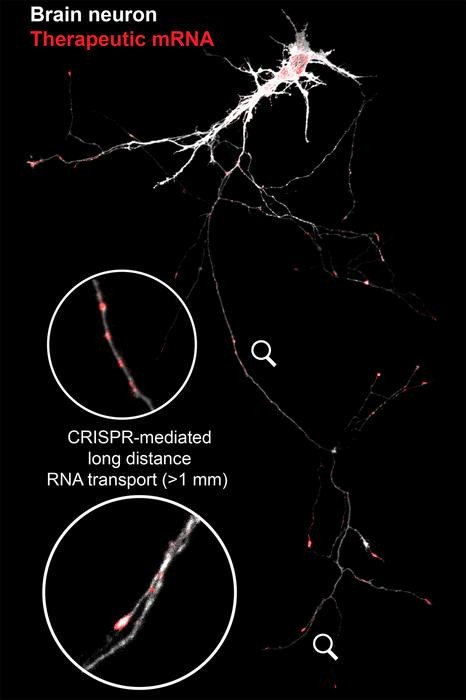
«Впервые мы использовали возможности технологии CRISPR для создания точного пространственного "почтового индекса", который доставляет молекулы РНК именно туда, где они необходимы в клетках», — говорит Стэнли Ци, доцент кафедры биоинженерии и старший автор статьи, опубликованной в журнале Nature. «Представьте, что вы можете целенаправленно воздействовать на поврежденные участки нейрона, восстанавливать их и способствовать росту — именно этого и добивается наша технология».
В последние годы исследователи поняли, что распределение РНК внутри клетки может быть не менее важным, чем то, что они способны делать. Длина отдельного нейрона может превышать метр, а старение, травмы и мутации нарушают его способность переносить крошечные РНК на такое расстояние.
«Терапевтическая РНК не сможет помочь, если она не попадет туда, где она нужна», — говорит Ци. «Мы хотели создать технологию, которая могла бы надежно доставлять РНК в место, где она должна функционировать».
Ци и его коллеги использовали версию инструмента для редактирования генов CRISPR под названием CRISPR-Cas13, чтобы нацеливаться на отдельные фрагменты РНК. Обычно CRISPR используется для нарезки и редактирования генетического кода, но в данном случае исследователи не хотели вносить никаких изменений. Они просто хотели переместить существующую РНК в новое место внутри клетки.
«Cas13 действует как ножницы, но мы спроектировали его так, чтобы он действовал как почтальон», — говорит Ци. «Тогда мы можем приказать ему перенести РНК из одного места в другое». Исследователи соединили Cas13 со специфическими сигналами локализации, которые действуют как адреса, указывая Cas13, куда доставить РНК. Каждое место в клетке имеет свою адресную молекулу, поэтому исследователи могут направлять РНК в разные места, добавляя в клетку различные молекулы.
Ученые использовали технологию, которую они назвали CRISPR-TO, чтобы проверить десятки фрагментов РНК и выяснить, поможет ли какая-нибудь из них росту нейронов. Они добавили CRISPR-TO к нейронам мозга мыши в чашке Петри, где она переносила молекулы РНК к кончикам нейритов — пальцеподобных выступов, которые образуют синапсы и соединяются с другими нейронами. Исследователи нашли несколько перспективных кандидатов, в том числе одну молекулу РНК, которая увеличила рост нейритов на 50% в течение 24 часов.
«Мы обнаруживаем все больше РНК-мишеней, которые могут способствовать росту и регенерации нейритов», — говорит Менгтинг Хань, автор статьи. «Мы добавили новый инструмент в инструментарий CRISPR для контроля локализации РНК внутри клетки. Этого никогда не удавалось достичь раньше, и это открывает новые терапевтические направления для лечения нейродегенеративных заболеваний».
Исследователи используют CRISPR-TO для скрининга дополнительных молекул РНК, чтобы определить, какие из них будут наиболее эффективны при восстановлении поврежденных нейронов в мозге мышей, а также в нейронах человека.
«Мы находимся в самом начале пути к пониманию того, как пространственная организация РНК способствует восстановлению мозга», — говорит Ци. В настоящее время исследователи используют CRISPR-TO для перемещения эндогенных РНК — молекул, которые естественным образом вырабатываются внутри клетки. Но его можно использовать и для обеспечения точного контроля лекарств на основе РНК, что сделает их более безопасными и эффективными.
«Этот потенциал нас очень радует», — говорит Ци. «Недостаточно, чтобы молекула просто находилась в клетке. Нужно, чтобы она находилась в нужном месте в нужное время. С помощью нашей точной программируемой технологии можно нацелить любую РНК на любой тип клеток и доставить ее в нужное место в организме».