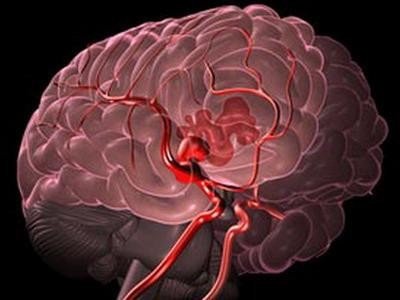
Совместные исследования нейрохирургов из ННИИПК им. акад. Е.Н. Мешалкина и ученых из Института гидродинамики им. акад. М.А. Лаврентьева СО РАН позволили разобраться с законами движения крови в сосудах головного мозга и описать методы управления кровотоком. Результаты исследований позволят добиться лучшего контроля над ходом операций на сосудах головного мозга и свести к минимуму послеоперационные риски, рассказывает сайт журнала Наука из первых рук.
Задача, поставленная хирургами перед математиками, звучала так: есть две операции, похожие по своим внешним результатам, но с различными клиническими исходами, требуется определить причины возникших осложнений и найти параметры, которые определяют безопасность хирургического лечения у пациентов со случайно выявленными аномалиями сосудов головного мозга.
Начали решать эту задачу исследователи с нового приборно-измерительного комплекса для эндоваскулярного интраоперационного мониторинга на основе американского прибора Volcano — российские ученые перепрограммировали его, чтобы использовать для измерения скорости и давления кровотока в сосудах головного мозга вместо коронарных сосудов, для которых он был изначально предназначен.
Измерения давления и скорости движения крови проводились до и после операции в одних и тех же точках, расположенных на различных расстояниях от аномалии. Это позволило получить точные качественные свойства и количественные параметры кровотока, сопутствующие аномалии. На основе этих данных была создана математическая модель кровотока головного мозга, которая позволяет предсказывать, что будет с сосудами при тех или иных показателях.
Для моделирования кровотока в сосудах головного мозга ученые решили использовать дифференциальное уравнение, описывающее нелинейный осциллятор Ван дер Поля-Дуффинга. Оно описывает поведение нелинейной пружинки, которая по-разному работает на растяжение и сжатие, и погружена в вязкую среду. Уравнение имеет широкий диапазон решений и позволяет измерять и оценивать важные свойства всех компонентов сложной среды: пульсирующий поток крови, упругие стенки сосуда и окружающую среду мозга.
«Модель нелинейного осциллятора хорошо моделирует поведение кровотока в окрестностях сосудистой аномалии и может показать, к чему это приводит. Когда мы увеличиваем параметры кровотока на модели, то в результате расчетов видим, что произойдет с организмом в реальности», — сказал Александр Чупахин, заведующий лабораторией Института гидродинамики СО РАН.
С использованием математической модели нейрохирурги в свою очередь смогли скорректировать схемы проведения операций. «Работа с гемодинамической моделью помогла понять, что начинать эмболизацию нужно с самого крупного сосуда, и лишь когда кровяной поток перераспределится, идти дальше. Этот принцип упрощает работу нейрохирурга: теперь он знает, какой сосуд из спутанного клубка выключать первым», — пояснил Кирилл Орлов, руководитель центра ангионеврологии и нейрохирургии ННИИПК им. акад. Е.Н. Мешалкина.
Не менее важным результатом стало понимание того, сколько времени требуется на перестройку кровообращения после операции. Оказалось, что не нужно ждать шесть месяцев, как было принято ранее, поскольку кровообращение перестраивается уже через неделю. «Это очень важно, потому что в течение года после операции у 4% пациентов случается кровоизлияние, а значит мы рискуем 2% жизней, когда отпускаем пациентов на полгода. Если же промежуток между операциями составляет неделю, риск сводится до минимума», — сказал Кирилл Орлов.